od Jason Wasserman MD PhD FRCPC a Zuzanna Gorski MD
Ledna 15, 2024
Invazivní adenokarcinom (také známý jako adenokarcinom tlustého střeva) je nejčastějším typem rakoviny tlustého střeva. Skládá se z buněk, které normálně pokrývají vnitřní povrch tlustého střeva. Tento typ rakoviny často začíná v polypu, jako je např tubulární adenom, tubulovilózní adenomnebo vilózní adenom.
Tento článek vám pomůže porozumět vaší diagnóze a zprávě o patologii pro invazivní adenokarcinom tlustého střeva.
Dvojtečka
Tlusté střevo je součástí trávicího systému a první částí tlustého střeva. Je to dlouhá dutá trubice, která začíná na konci tenkého střeva a končí v konečníku. Dvojtečka je rozdělena do čtyř částí: vzestupná (vpravo), příčná, sestupná (vlevo) a sigmoidální. Hraje zásadní roli při zpracování odpadních látek a vstřebávání vody, elektrolytů a některých vitamínů. Invazivní adenokarcinom může vzniknout v kterékoli části tlustého střeva.
Co způsobuje invazivní adenokarcinom v tlustém střevě?
Předpokládá se, že invazivní adenokarcinom v tlustém střevě je způsoben kombinací environmentálních a genetických faktorů. Mezi zavedené rizikové faktory patří nadměrná konzumace zpracovaného masa, červeného masa a alkoholu. Lidé s nadbytkem tělesného tuku jsou také vystaveni zvýšenému riziku vzniku tohoto typu rakoviny. Prodloužená zánět v tlustém střevě, což lze pozorovat u zánětlivého onemocnění střev (ulcerózní kolitida a Crohnova choroba), je také spojeno se zvýšeným rizikem rozvoje invazivního adenokarcinomu.
Jaké jsou příznaky invazivního adenokarcinomu tlustého střeva?
Příznaky invazivního adenokarcinomu závisí na umístění nádoru v tlustém střevě. Nádory v levém tlustém střevě (sestupném tračníku) nebo konečníku mohou způsobit změny ve vyprazdňování, krvavou stolici, bolesti břicha nebo nadýmání. Nádory v pravém tlustém střevě (vzestupném tračníku) nemusí způsobovat žádné příznaky, dokud není nádor velmi velký nebo se nerozšíří do jiných částí těla.
Kde v tlustém střevě začíná invazivní adenokarcinom?
Vzniká invazivní adenokarcinom tlustého střeva epitelové buňky se běžně nachází na vnitřním povrchu tlustého střeva. Tyto epiteliální buňky se spojují a vytvářejí struktury tzv žlázy. Žlázy spolu s podložní lamina propria a muscularis sliznice tvoří tenkou vrstvu tkáně nazývanou sliznice. Pokud jsou nádorové buňky umístěny zcela ve sliznici, nazývá se tento stav dysplazie vysokého stupně.
Dysplazie vysokého stupně je považována za neinvazivní, prekancerózní stav a nádorové buňky nemohou metastazovat (rozšíří se) na další části těla. Jak však nádor roste a buňky napadají spodní vrstvy tkáně, diagnóza se mění na invazivní adenokarcinom. Na rozdíl od dysplazie vysokého stupně mohou nádorové buňky u invazivního karcinomu metastázovat (šířit se) do lymfatické uzliny a další části těla.

Mikroskopické rysy tohoto nádoru
Při mikroskopickém vyšetření se invazivní adenokarcinom tlustého střeva skládá ze skupin abnormálních epitelové buňky obvykle uspořádány v konstantní velikosti žlázy (které mohou vypadat podobně jako normální žlázy v tlustém střevě), hnízda nebo prostěradla.
Co hledat ve své patologické zprávě pro invazivní adenokarcinom tlustého střeva:
Mucinózní diferenciace
Patologové používají termín mucinózní diferenciace k popisu nádorů, které obsahují velké množství extracelulárního mucin. Mucin je specializovaný typ proteinu tvořený normálními buňkami i nádorovými buňkami. Extracelulární znamená, že mucin byl pozorován mimo nádorové buňky. Pokud je více než 50 % nádoru tvořeno mucinem, nazývá se nádor mucinózní adenokarcinom.
Histologický stupeň
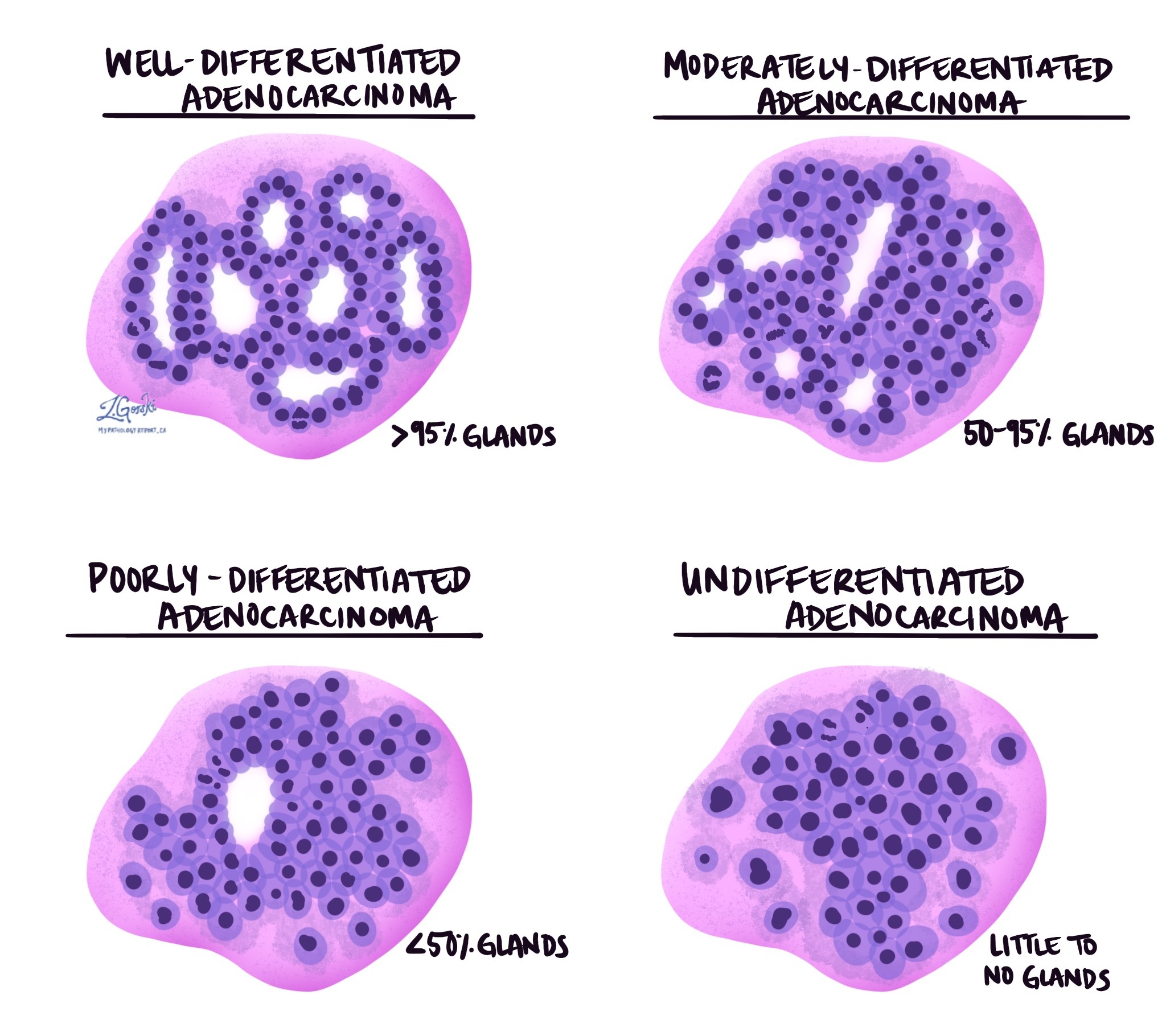
Invazivní adenokarcinom tlustého střeva se dělí do tří stupňů – dobře diferencovaný, středně diferencovaný a málo diferencovaný. Stupeň je založen na procentu nádorových buněk tvořících kulaté struktury tzv žlázy. Nádor, který netvoří žádné žlázy, se nazývá nediferencovaný. Stupeň je důležitý, protože špatně diferencované a nediferencované nádory mají tendenci se chovat agresivněji; například tyto nádory se s větší pravděpodobností rozšíří do lymfatické uzliny a další části těla.
- Dobře diferencovaný: Více než 95 % nádoru zahrnuje žlázy. Patologové také popisují tyto nádory jako 1. stupeň.
- Středně diferencovaný: 50 až 95 % nádoru zahrnuje žlázy. Patologové také popisují tyto nádory jako 2. stupeň.
- Špatně diferencovaný: Méně než 50 % nádoru zahrnuje žlázy. Patologové také popisují tyto nádory jako 3. stupeň.
- Nediferencované: Velmi málo žláz je vidět kdekoli v nádoru.
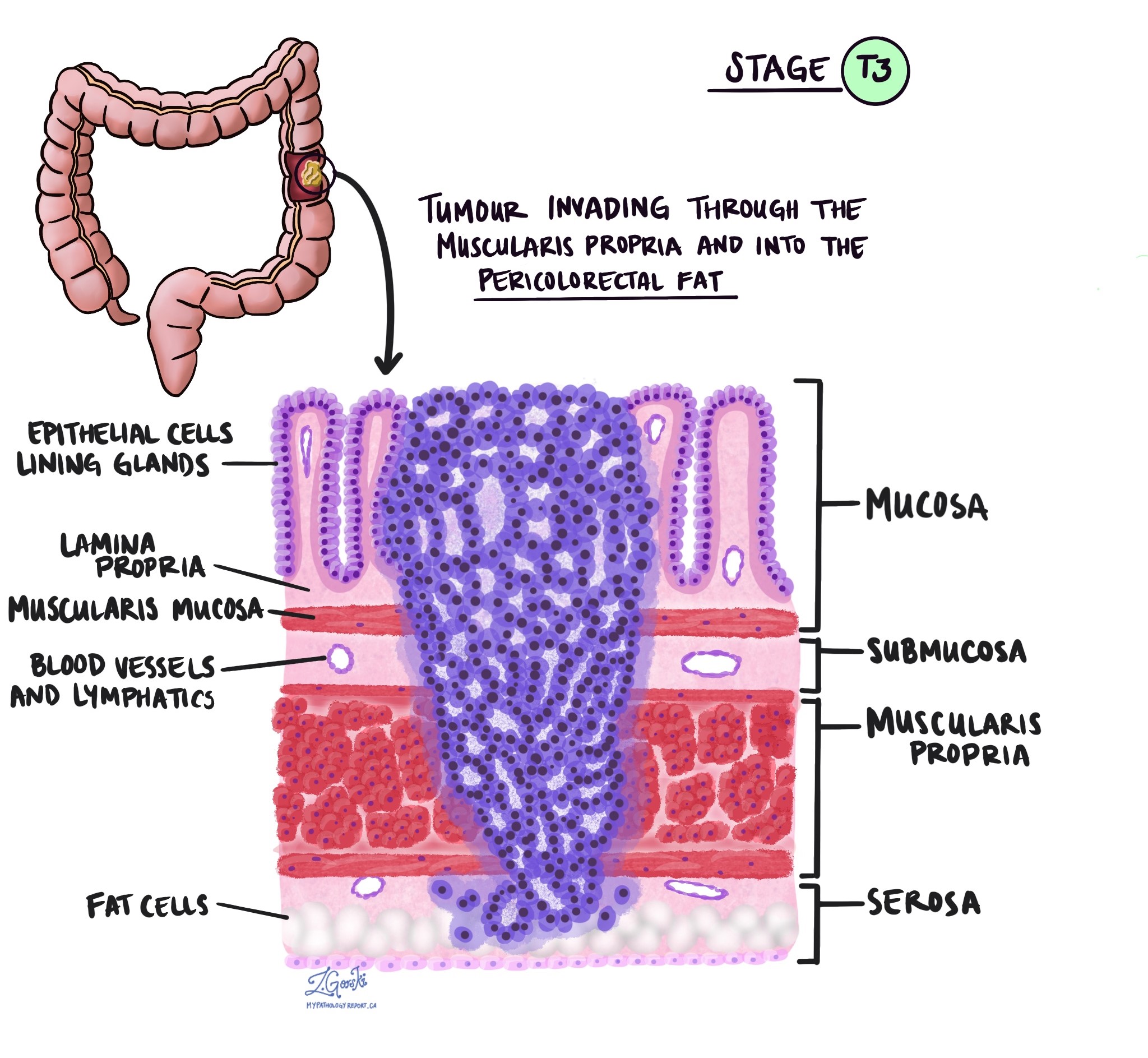
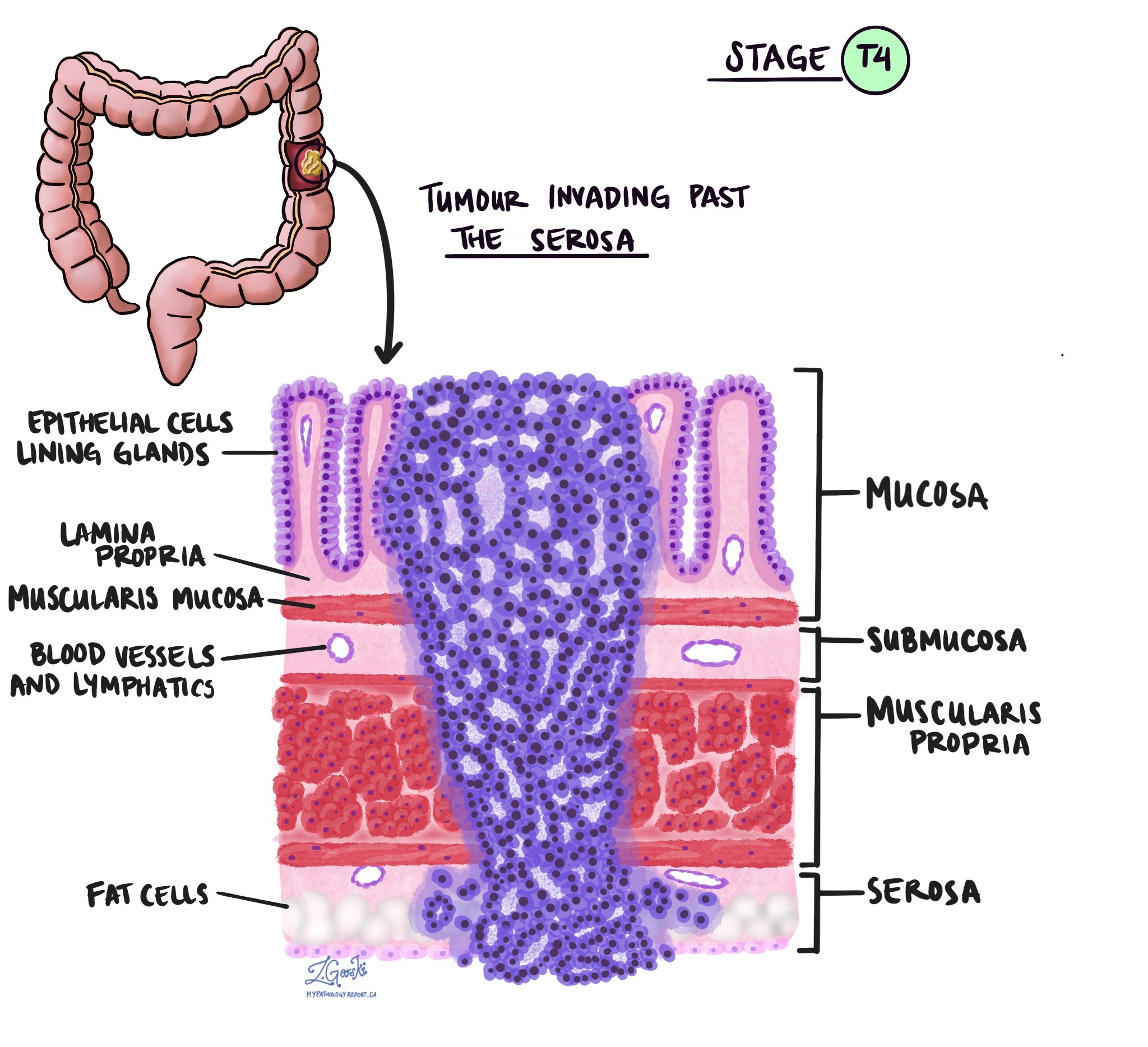
Hloubka invaze a patologické stadium nádoru (pT)
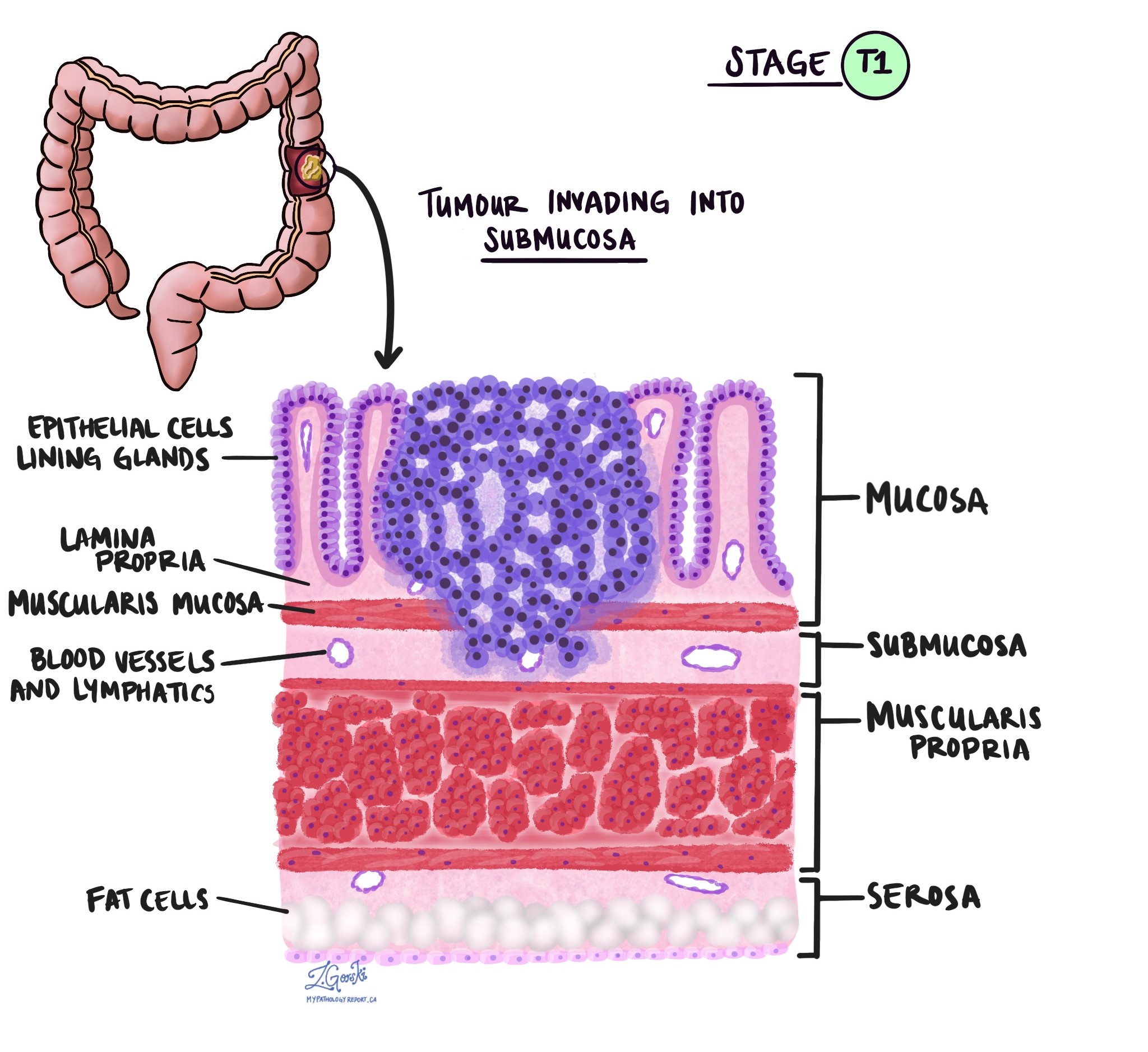
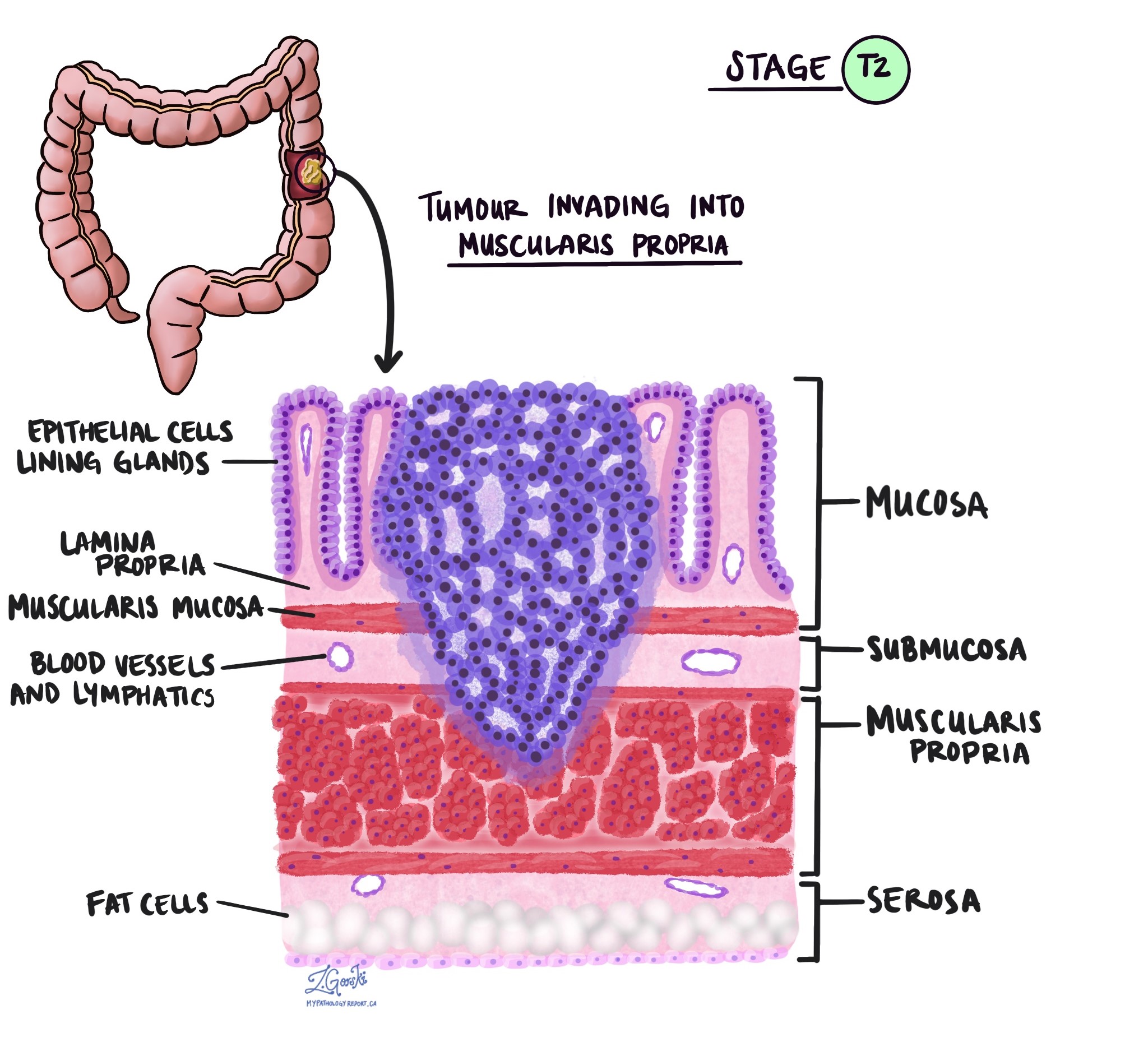
V patologii termín invaze popisuje šíření rakovinných buněk do orgánů nebo tkání obklopujících místo, kde nádor začal. Protože invazivní adenokarcinom tlustého střeva začíná v tenké vrstvě tkáně na vnitřním povrchu tlustého střeva, tzv. slizniceInvaze je definována jako šíření rakovinných buněk do dalších vrstev tkáně v tlustém střevě nebo jakýchkoli jiných orgánech mimo tlusté střevo. Invazi lze pozorovat až po vyšetření nádoru pod mikroskopem patologem.
Při vyšetření nádoru pod mikroskopem váš patolog uvidí, jak daleko se rakovinné buňky rozšířily ze sliznice do okolní tkáně. Tomu se říká hloubka nebo úroveň invaze. Hloubka invaze je důležitá, protože nádory, které pronikají hlouběji do stěny tlustého střeva, se s větší pravděpodobností rozšíří do dalších částí těla, např. lymfatické uzliny, játra nebo plíce. Úroveň invaze se také používá k určení patologického stadia nádoru (pT). Obrázky níže ukazují vztah mezi hloubkou invaze a patologickým stadiem nádoru.
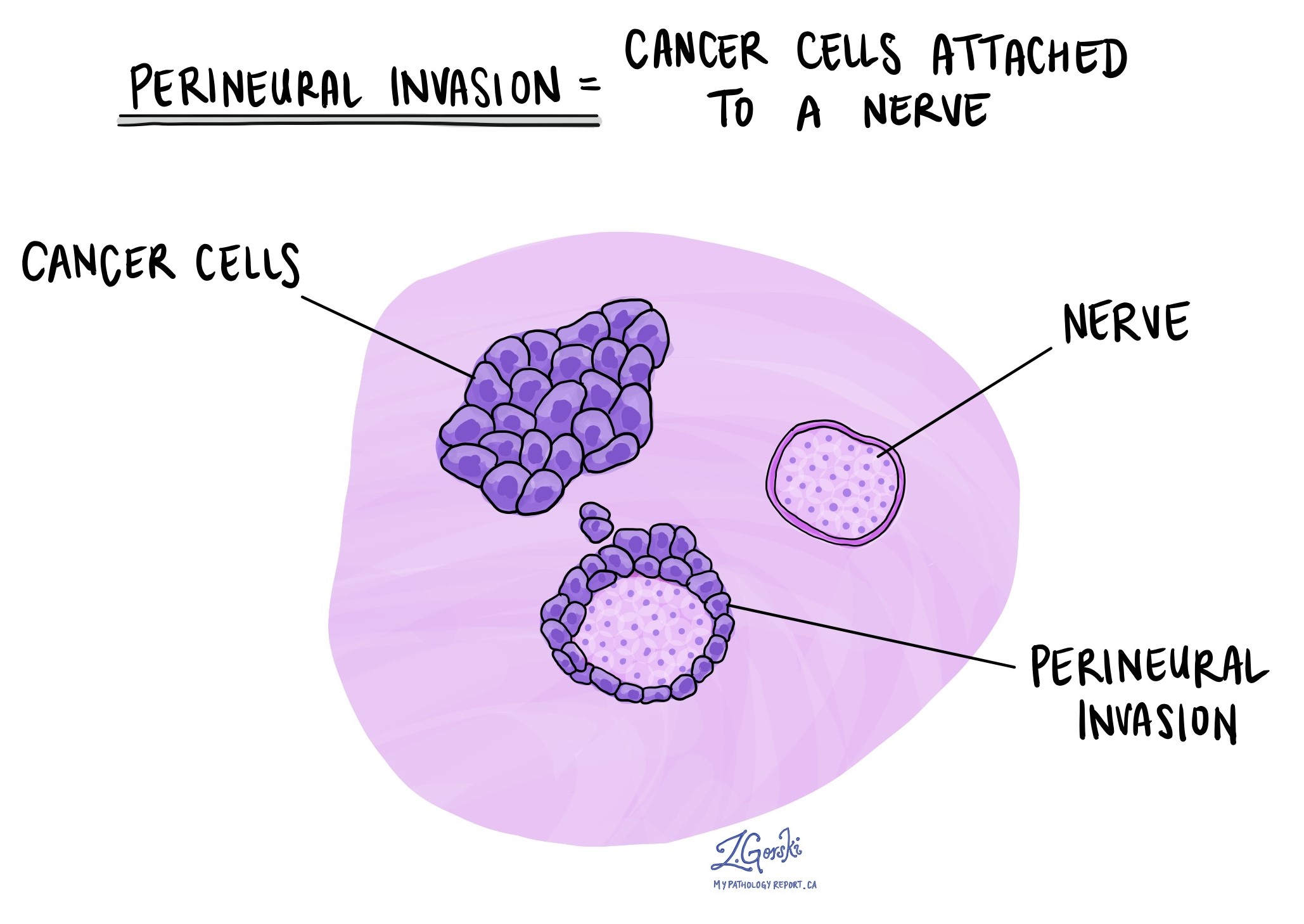
Perineurální invaze
Patologové používají termín „perineurální invaze“ k popisu situace, kdy se rakovinné buňky připojí k nervu nebo na něj napadnou. „Intraneurální invaze“ je příbuzný termín, který konkrétně odkazuje na rakovinné buňky nalezené uvnitř nervu. Nervy, připomínající dlouhé dráty, se skládají ze skupin buněk známých jako neurony. Tyto nervy, přítomné v celém těle, přenášejí mezi tělem a mozkem informace, jako je teplota, tlak a bolest. Přítomnost perineurální invaze je důležitá, protože umožňuje rakovinným buňkám cestovat podél nervu do blízkých orgánů a tkání, což zvyšuje riziko recidivy nádoru po operaci.
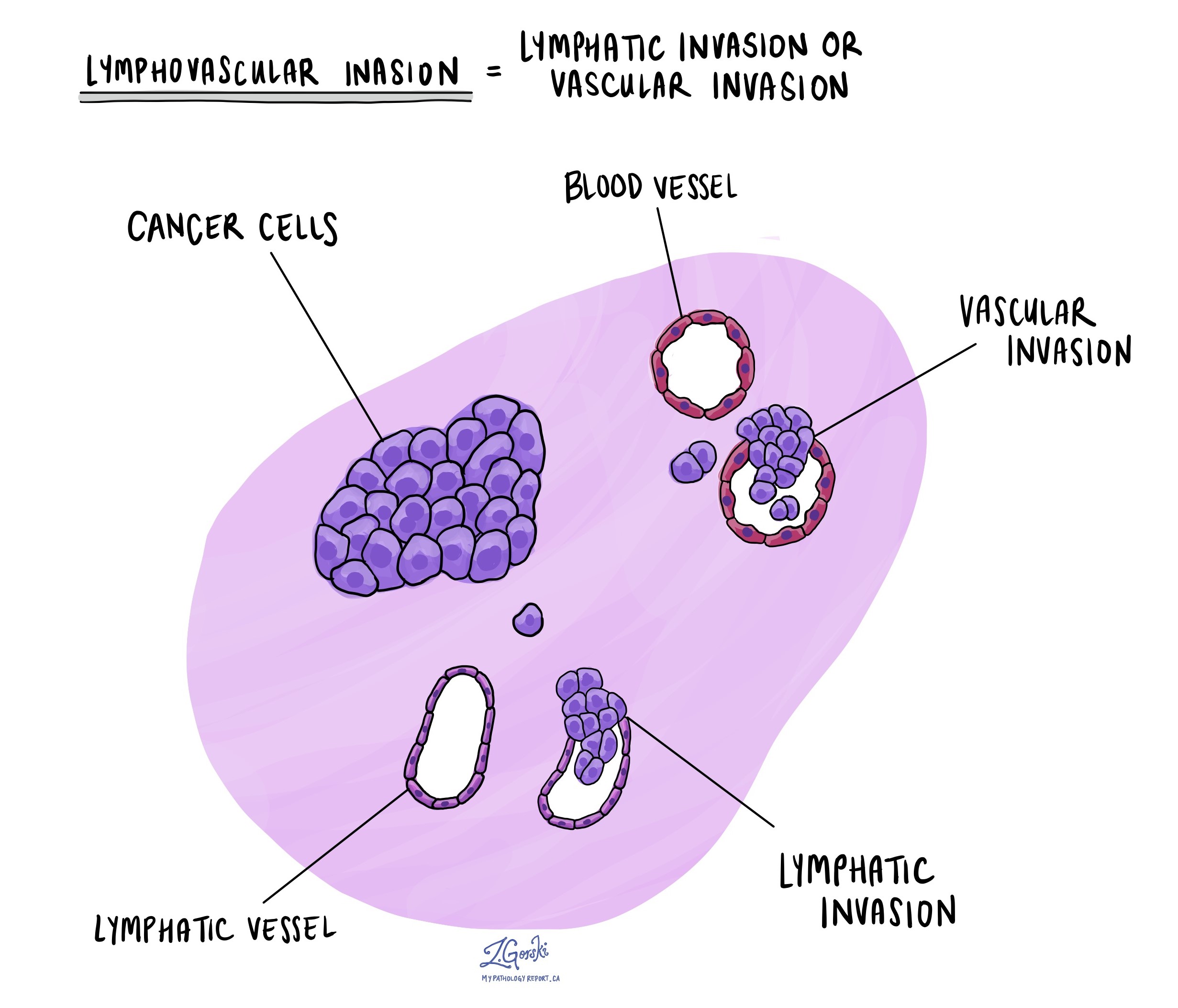
Lymfovaskulární invaze
Lymfovaskulární invaze nastává, když rakovinné buňky napadnou krevní cévu nebo lymfatickou cévu. Krevní cévy jsou tenké trubice, které vedou krev po celém těle, zatímco lymfatické cévy nesou místo krve tekutinu zvanou lymfa. Tyto lymfatické cévy se připojují k malým imunitním orgánům rozptýleným po celém těle, tzv lymfatické uzliny.
Lymfovaskulární invaze je důležitá, protože umožňuje rakovinným buňkám šířit se do jiných částí těla, včetně lymfatických uzlin nebo jater, prostřednictvím krevních nebo lymfatických cév. Kromě toho přítomnost rakovinných buněk uvnitř velké žíly za stěnou tlustého střeva (mimo tlustý svazek svalů) je spojena s vysokým rizikem, že rakovinné buňky budou nakonec nalezeny v játrech.
Okraje
V patologii je okraj okrajem tkáně odstraněné během operace nádoru. Stav okraje ve zprávě o patologii je důležitý, protože ukazuje, zda byl odstraněn celý nádor, nebo zda nějaký zůstal. Tyto informace pomáhají určit potřebu další léčby.
Patologové obvykle hodnotí okraje po chirurgickém zákroku, jako je např vyříznutí or resekce, zaměřené na odstranění celého nádoru. Marže se obvykle nevyhodnocují po a biopsie, která odstraní pouze část nádoru. Počet hlášených okrajů a jejich velikost – kolik normální tkáně je mezi nádorem a hranou řezu – se liší v závislosti na typu tkáně a umístění nádoru.
Patologové zkoumají okraje, aby zkontrolovali, zda jsou na řezné hraně tkáně přítomny nádorové buňky. Pozitivní okraj, kde se nacházejí nádorové buňky, naznačuje, že určitá rakovina může v těle zůstat. Naproti tomu negativní okraj bez nádorových buněk na okraji naznačuje, že nádor byl zcela odstraněn. Některé zprávy také měří vzdálenost mezi nejbližšími nádorovými buňkami a okrajem, i když jsou všechny okraje negativní.

Pučení nádoru
Tumor pudding je termín, který patologové používají k popisu buď jednotlivých rakovinných buněk nebo malých skupin rakovinných buněk pozorovaných na okraji nádoru. Předpokládá se, že je to známka toho, že nádor je stále méně diferencovaný. Na základě počtu pupenů pozorovaných pod mikroskopem je přiřazeno skóre, buď nízké, střední nebo vysoké. Vysoké skóre je spojeno se zvýšeným rizikem, že se rakovinné buňky rozšíří do jiné části těla.
Léčebný účinek
Pokud jste před odstraněním nádoru podstoupili léčbu rakoviny (buď chemoterapii nebo radiační terapii nebo obojí), váš patolog pečlivě prozkoumá oblast tkáně, kde byl nádor dříve identifikován, aby zjistil, zda jsou nějaké rakovinné buňky stále živé (životaschopné). Nejčastěji používaný systém popisuje účinek léčby na stupnici od 0 do 3, přičemž 0 znamená žádné životaschopné rakovinné buňky (všechny rakovinné buňky jsou mrtvé) a 3 je rozsáhlá reziduální rakovina bez zjevné regrese nádoru (všechny nebo většina rakovinné buňky jsou živé).
Nádorové ložisko
Nádorové ložisko je skupina rakovinných buněk, které jsou oddělené od hlavního nádoru, ale nejsou v a lymfatická uzlina. Nádorová ložiska jsou spojena s vyšším rizikem, že se nádorové buňky po léčbě rozšíří do jiné části těla, jako jsou játra nebo plíce. Nádorová depozita také určují patologické stadium nádoru (pT).
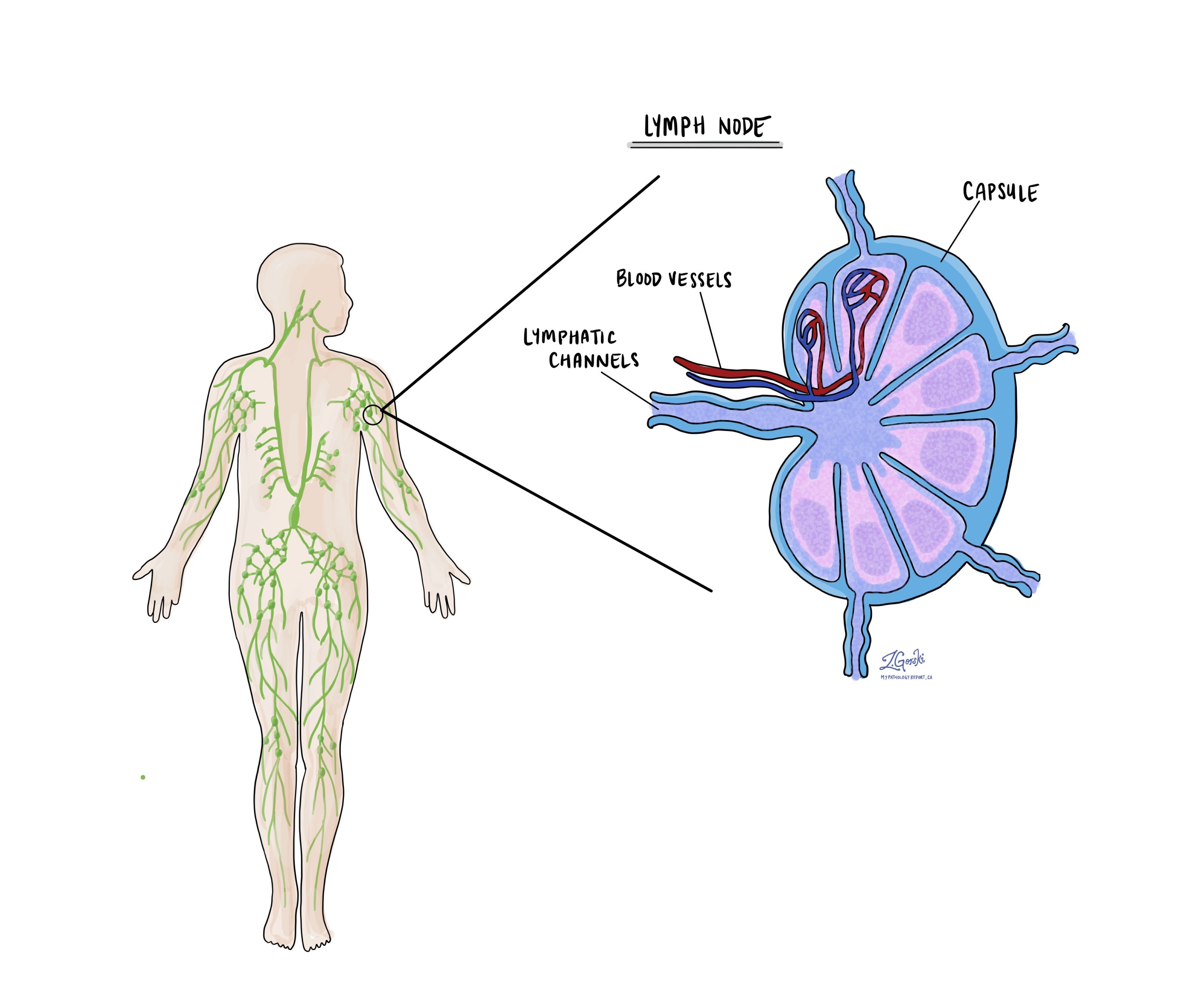
Lymfatické uzliny
Malé imunitní orgány, známé jako lymfatické uzliny, jsou umístěny po celém těle. Rakovinné buňky mohou cestovat z nádoru do těchto lymfatických uzlin prostřednictvím drobných lymfatických cév. Z tohoto důvodu lékaři často odebírají a mikroskopicky vyšetřují lymfatické uzliny, aby hledali rakovinné buňky. Tento proces, kdy se rakovinné buňky přesouvají z původního nádoru do jiné části těla, jako je lymfatická uzlina, se nazývá metastáza.
Rakovinové buňky obvykle nejprve migrují do lymfatických uzlin v blízkosti nádoru, i když mohou být postiženy i vzdálené lymfatické uzliny. V důsledku toho chirurgové obvykle nejprve odstraní lymfatické uzliny nejblíže nádoru. Mohou odstranit lymfatické uzliny dále od nádoru, pokud jsou zvětšené a existuje silné podezření, že obsahují rakovinné buňky.
Patologové vyšetří všechny odstraněné lymfatické uzliny pod mikroskopem a nálezy budou podrobně uvedeny ve vaší zprávě. „Pozitivní“ výsledek znamená přítomnost rakovinných buněk v lymfatických uzlinách, zatímco „negativní“ výsledek znamená, že nebyly nalezeny žádné rakovinné buňky. Pokud zpráva najde rakovinné buňky v lymfatické uzlině, může také specifikovat velikost největšího shluku těchto buněk, často označovaného jako „focus“ nebo „depozit“. Extranodální extenze nastává, když nádorové buňky proniknou do vnějšího pouzdra lymfatické uzliny a šíří se do sousední tkáně.
Vyšetření lymfatických uzlin je důležité ze dvou důvodů. Za prvé, pomáhá určit patologické uzlové stadium (pN). Za druhé, objev rakovinných buněk v lymfatické uzlině naznačuje zvýšené riziko pozdějšího nalezení rakovinných buněk v jiných částech těla. Tyto informace vedou vašeho lékaře při rozhodování, zda potřebujete další léčbu, jako je chemoterapie, radiační terapie nebo imunoterapie.
Mismatch repair proteiny
Mismatch repair (MMR) je systém uvnitř všech normálních, zdravých buněk, který opravuje chyby v našem genetickém materiálu (DNA). Systém se skládá z různých proteinů a čtyři nejběžnější jsou MSH2, MSH6, MLH1 a PMS2.
Čtyři proteiny pro opravu chybného párování MSH2, MSH6, MLH1 a PMS2 pracují v párech a opravují poškozenou DNA. Konkrétně MSH2 pracuje s MSH6 a MLH1 pracuje s PMS2. Pokud dojde ke ztrátě jednoho proteinu, pár nemůže normálně fungovat a zvyšuje se riziko vzniku rakoviny.
Jak patologové testují proteiny pro opravu neshody?
Nejběžnějším způsobem testování proteinů pro opravu neshody je imunohistochemie. Tento test umožňuje patologům zjistit, zda nádorové buňky produkují všechny čtyři chybné opravné proteiny. Výsledky tohoto testu jsou obvykle hlášeny takto:
- Normální výsledek: Zachovaná exprese proteinu.
- Abnormální výsledek: Ztráta exprese proteinu.
Proč je testování proteinů pro opravu nesouladu důležité?
Testování opravy nesouladu je důležité, protože může pomoci předpovědět, jak dobře mohou některé léčby fungovat. Například rakoviny se ztrátou exprese chybného opravného proteinu budou pravděpodobněji reagovat na imunoterapeutické léčby, jako jsou inhibitory PD-1 nebo PD-L1. Je to proto, že vysoký počet mutací, které se často vyskytují v deficientních nádorech, může produkovat nové antigeny, díky nimž je nádor viditelnější a zranitelnější vůči imunitnímu systému.
Testování opravy nesouladu se také provádí k identifikaci pacientů, kteří mohou mít Lynchův syndrom, známý také jako hereditární nepolypózní kolorektální karcinom (HNPCC). Lynchův syndrom je genetická porucha, která zvyšuje riziko vzniku různých typů rakoviny, včetně rakoviny jícnu, rakoviny tlustého střeva, rakoviny endometria, rakoviny vaječníků a rakoviny žaludku.
Jiné genetické změny zjištěné u invazivního adenokarcinomu tlustého střeva a konečníku
- Mutace genu APC (Adenomatous Polyposis Coli): Téměř všudypřítomné u sporadických případů rakoviny tlustého střeva jsou mutace v genu APC často časnou událostí ve vývoji kolorektálního karcinomu. APC gen je tumor supresorový gen a jeho inaktivace vede k abnormálnímu buněčnému růstu.
- Mutace KRAS a NRAS: Mutace v genech KRAS a NRAS, které jsou součástí rodiny genů RAS, se vyskytují přibližně u 40–45 % kolorektálních karcinomů. Tyto mutace vedou k nekontrolovanému buněčnému dělení a růstu. Zejména přítomnost mutací KRAS je spojena s rezistencí vůči určitým terapiím anti-EGFR (receptor epidermálního růstového faktoru).
- Mutace BRAF: Mutace genu BRAF, zejména V600E, se nachází asi u 10 % kolorektálních karcinomů. Často je spojena se špatnou prognózou a rezistencí k některým terapiím. Mutace BRAF jsou častější u rakovin, které se vyvinuly vroubkovanou dráhou.
- Mutace PIK3CA: Mutace v genu PIK3CA, který kóduje podjednotku fosfatidylinositol 3-kinázy (PI3K), se vyskytují přibližně u 10–20 % kolorektálních karcinomů. Tyto mutace mohou aktivovat signální dráhu AKT, podporovat buněčnou proliferaci a přežití.
Testy používané k detekci genetických změn
- Sekvenování nové generace (NGS): NGS umožňuje současné zkoumání více genů k detekci mutací, delecí a amplifikace. Tento komplexní přístup může posoudit všechny běžné genetické změny u kolorektálního karcinomu, včetně mutací APC, KRAS, NRAS, BRAF a PIK3CA.
- Polymerázová řetězová reakce (PCR): Tato technika amplifikuje segmenty DNA, což umožňuje analyzovat specifické genetické změny, jako jsou mutace KRAS, NRAS a BRAF.
- Fluorescenční in situ hybridizace (FISH): FISH dokáže identifikovat genetické abnormality, jako jsou amplifikace nebo delece ve specifických genech. Méně běžně se používá pro rutinní detekci zmíněných genetických změn, ale může být užitečný ve specifických kontextech.
O tomto článku
Lékaři napsali tento článek, aby vám pomohl přečíst a porozumět vaší patologické zprávě. Kontakt pokud máte dotazy k tomuto článku nebo k vaší zprávě o patologii. Úplný úvod do zprávy o patologii najdete v článku tento článek.