od Jason Wasserman MD PhD FRCPC a Zuzanna Gorski MD
Januára 15, 2024
Invazívny adenokarcinóm (tiež známy ako adenokarcinóm hrubého čreva) je najbežnejším typom rakoviny hrubého čreva. Skladá sa z buniek, ktoré bežne pokrývajú vnútorný povrch hrubého čreva. Tento typ rakoviny často začína v polype, ako je napr tubulárny adenóm, tubulovilózny adenóm, Alebo vilózny adenóm.
Tento článok vám pomôže pochopiť vašu diagnózu a správu o patológii pre invazívny adenokarcinóm hrubého čreva.
Dvojbodka
Hrubé črevo je súčasťou tráviaceho systému a prvou časťou hrubého čreva. Je to dlhá dutá trubica, ktorá začína na konci tenkého čreva a končí v konečníku. Hrubé črevo je rozdelené na štyri časti: vzostupné (vpravo), priečne, zostupné (vľavo) a sigmoidné. Zohráva kľúčovú úlohu pri spracovaní odpadových látok a absorpcii vody, elektrolytov a niektorých vitamínov. Invazívny adenokarcinóm môže vzniknúť v ktorejkoľvek časti hrubého čreva.
Čo spôsobuje invazívny adenokarcinóm v hrubom čreve?
Predpokladá sa, že invazívny adenokarcinóm v hrubom čreve je spôsobený kombináciou environmentálnych a genetických faktorov. Medzi overené rizikové faktory patrí nadmerná konzumácia spracovaného mäsa, červeného mäsa a alkoholu. Ľudia s nadmerným telesným tukom sú tiež vystavení zvýšenému riziku vzniku tohto typu rakoviny. Predĺžená zápal v hrubom čreve, čo možno pozorovať pri zápalovom ochorení čriev (ulcerózna kolitída a Crohnova choroba), sa tiež spája so zvýšeným rizikom vzniku invazívneho adenokarcinómu.
Aké sú príznaky invazívneho adenokarcinómu hrubého čreva?
Príznaky invazívneho adenokarcinómu závisia od umiestnenia nádoru v hrubom čreve. Nádory v ľavom hrubom čreve (zostupnom hrubom čreve) alebo konečníku môžu spôsobiť zmeny vo vyprázdňovaní, krvavú stolicu, bolesti brucha alebo nadúvanie. Nádory v pravom hrubom čreve (vo vzostupnom hrubom čreve) nemusia spôsobovať žiadne príznaky, kým nádor nie je veľmi veľký alebo sa nerozšíri do iných častí tela.
Kde v hrubom čreve začína invazívny adenokarcinóm?
Invazívny adenokarcinóm hrubého čreva vzniká z epitelové bunky sa bežne nachádza na vnútornom povrchu hrubého čreva. Tieto epitelové bunky sa spájajú a vytvárajú štruktúry tzv žaluďov. Žľazy spolu so spodnou vrstvou lamina propria a muscularis sliznice tvoria tenkú vrstvu tkaniva nazývanú sliznica. Keď sú nádorové bunky umiestnené úplne v sliznici, stav sa nazýva dysplázia vysokého stupňa.
Dysplázia vysokého stupňa sa považuje za neinvazívny, prekancerózny stav a nádorové bunky nemôžu metastázovať (rozšíriť) do iných častí tela. Keď však nádor rastie a bunky napádajú spodné vrstvy tkaniva, diagnóza sa mení na invazívny adenokarcinóm. Na rozdiel od dysplázie vysokého stupňa môžu nádorové bunky pri invazívnom karcinóme metastázovať (šíriť sa) do lymfatické uzliny a ďalšie časti tela.

Mikroskopické znaky tohto nádoru
Pri mikroskopickom vyšetrení pozostáva invazívny adenokarcinóm hrubého čreva zo skupín abnormálnych epitelové bunky zvyčajne usporiadané v rovnakej veľkosti žaluďov (ktoré môžu vyzerať podobne ako normálne žľazy v hrubom čreve), hniezda alebo plachty.
Čo hľadať vo svojej patologickej správe o invazívnom adenokarcinóme hrubého čreva:
Mucinózna diferenciácia
Patológovia používajú termín mucinózna diferenciácia na označenie nádorov, ktoré obsahujú veľké množstvo extracelulárneho mucín. Mucín je špecializovaný typ proteínu, ktorý tvoria normálne bunky aj nádorové bunky. Extracelulárny znamená, že mucín bol pozorovaný mimo nádorových buniek. Ak viac ako 50 % nádoru tvorí mucín, nádor sa nazýva mucinózny adenokarcinóm.
Histologický stupeň
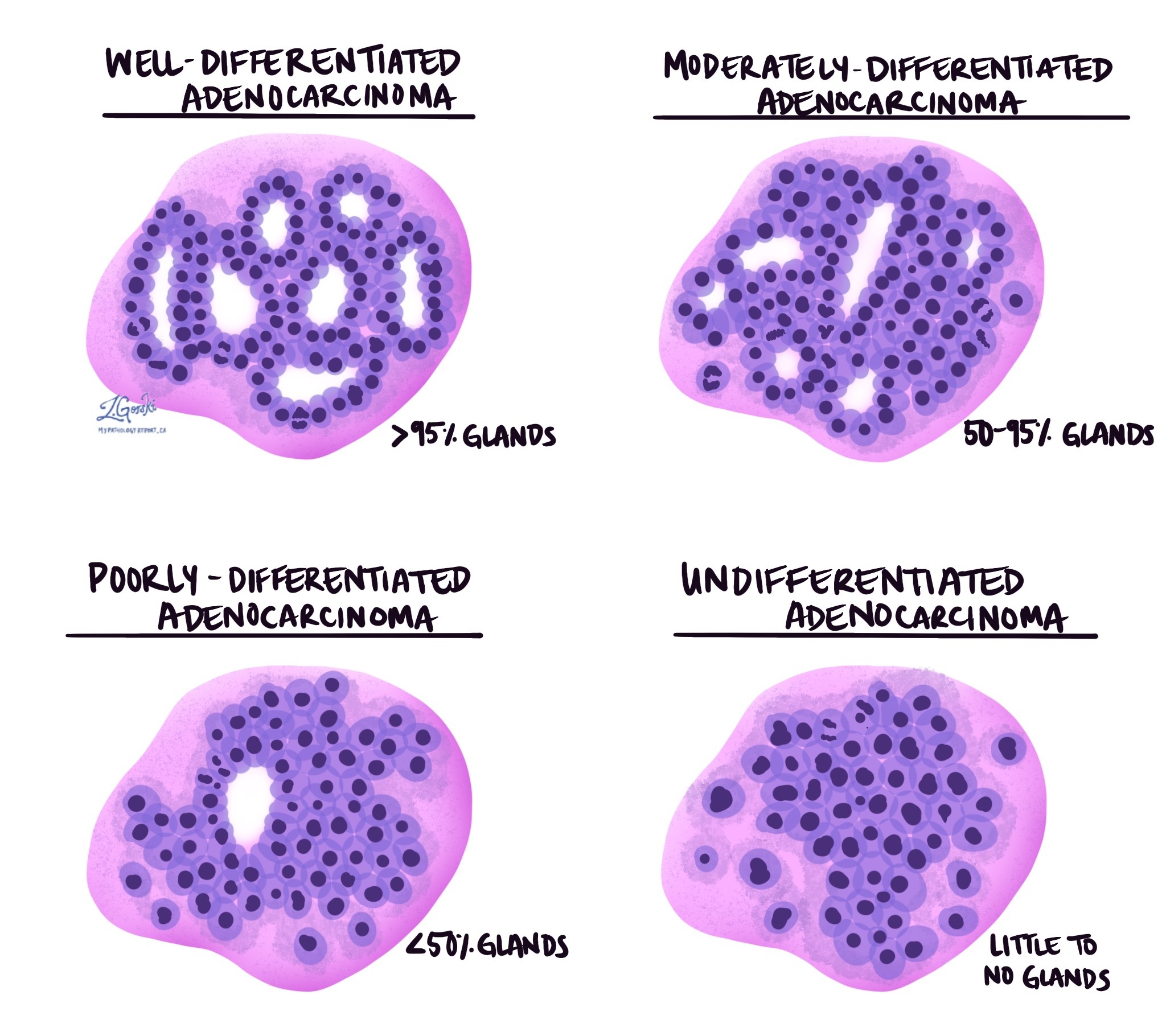
Invazívny adenokarcinóm hrubého čreva je rozdelený do troch stupňov – dobre diferencovaný, stredne diferencovaný a slabo diferencovaný. Stupeň je založený na percente nádorových buniek tvoriacich okrúhle štruktúry tzv žaluďov. Nádor, ktorý netvorí žiadne žľazy, sa nazýva nediferencovaný. Stupeň je dôležitý, pretože zle diferencované a nediferencované nádory majú tendenciu správať sa agresívnejšie; napríklad tieto nádory sa s väčšou pravdepodobnosťou rozšíria do lymfatické uzliny a ďalšie časti tela.
- Dobre diferencované: Viac ako 95 % nádoru zahŕňa žľazy. Patológovia tiež popisujú tieto nádory ako 1. stupeň.
- Stredne diferencované: 50 až 95 % nádoru zahŕňa žľazy. Patológovia tiež popisujú tieto nádory ako 2. stupeň.
- Zle diferencovaný: Menej ako 50 % nádoru obsahuje žľazy. Patológovia tiež popisujú tieto nádory ako 3. stupeň.
- Nediferencované: Veľmi málo žliaz je vidieť kdekoľvek v nádore.
Hĺbka invázie a patologické štádium nádoru (pT)
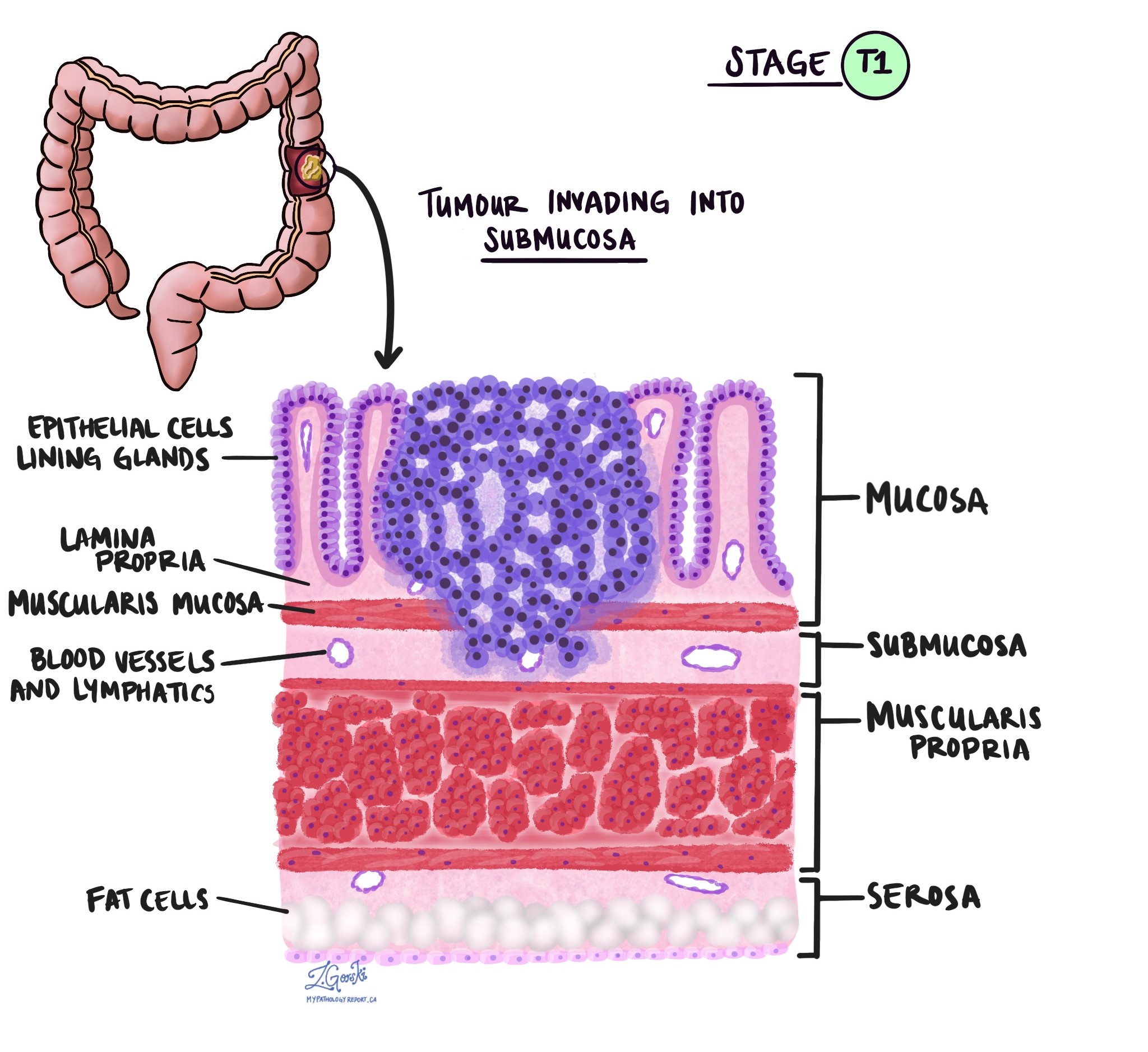
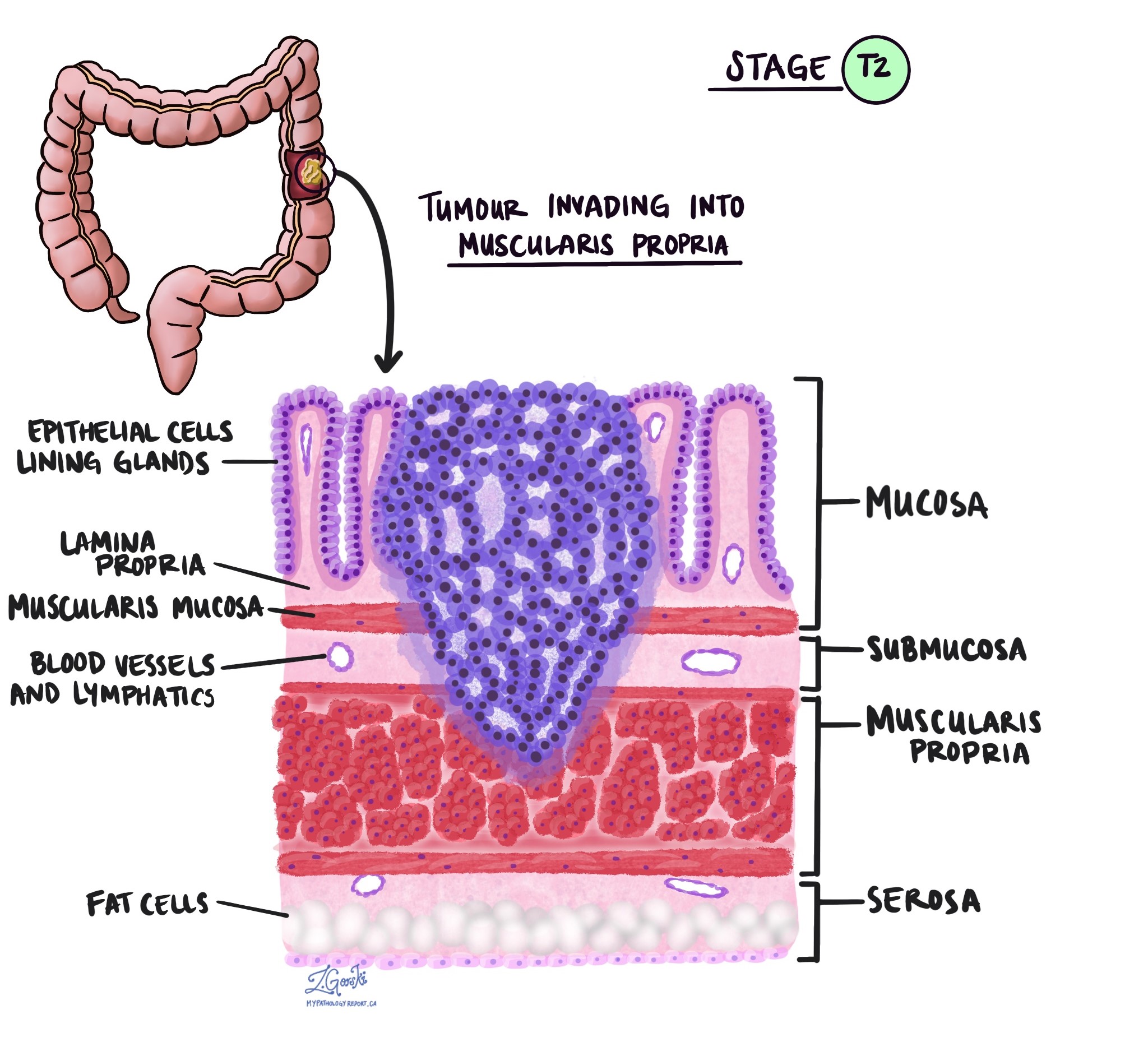
V patológii termín invázie opisuje šírenie rakovinových buniek do orgánov alebo tkanív obklopujúcich miesto, kde nádor začal. Pretože invazívny adenokarcinóm hrubého čreva začína v tenkej vrstve tkaniva na vnútornom povrchu hrubého čreva tzv. slizniceinvázia je definovaná ako šírenie rakovinových buniek do iných vrstiev tkaniva v hrubom čreve alebo akýchkoľvek iných orgánoch mimo hrubého čreva. Inváziu je možné vidieť až po vyšetrení nádoru pod mikroskopom patológom.
Pri skúmaní nádoru pod mikroskopom váš patológ uvidí, ako ďaleko sa rakovinové bunky rozšírili zo sliznice do okolitého tkaniva. Toto sa nazýva hĺbka alebo úroveň invázie. Hĺbka invázie je dôležitá, pretože nádory, ktoré prenikajú hlbšie do steny hrubého čreva, sa s väčšou pravdepodobnosťou rozšíria do iných častí tela, ako napr. lymfatické uzliny, pečeň alebo pľúca. Úroveň invázie sa tiež používa na určenie patologického štádia nádoru (pT). Obrázky nižšie ukazujú vzťah medzi hĺbkou invázie a patologickým štádiom nádoru.
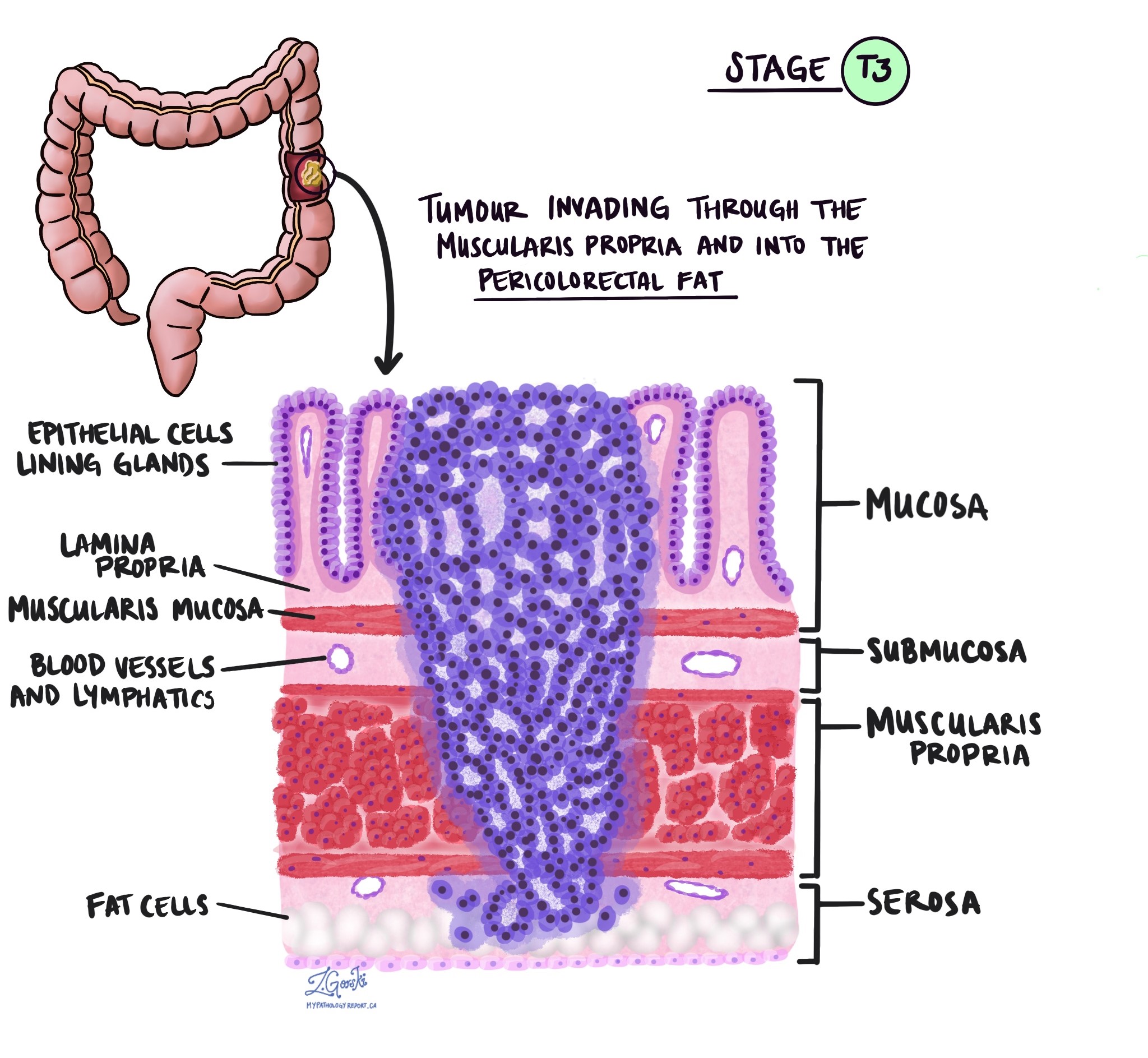
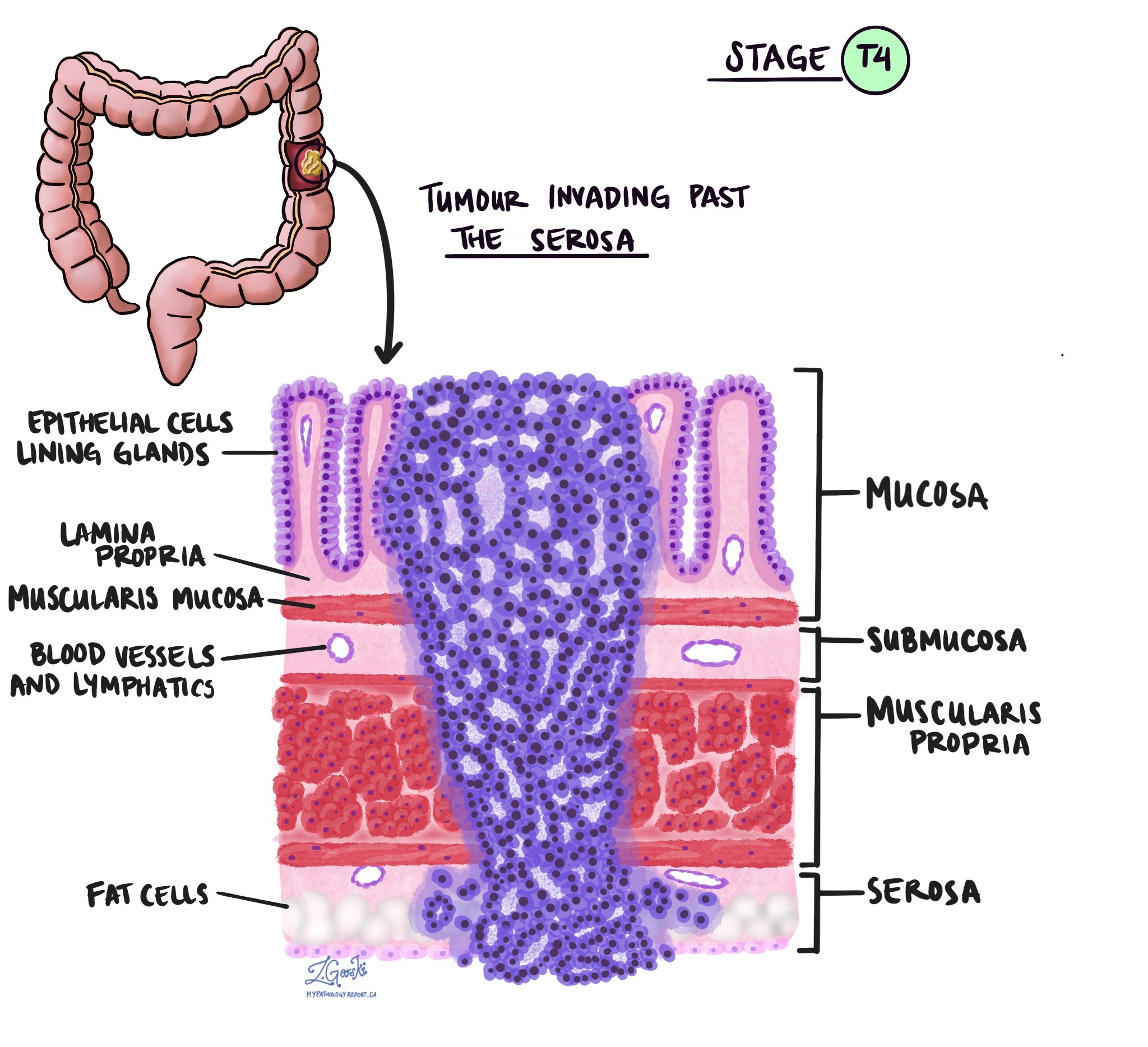
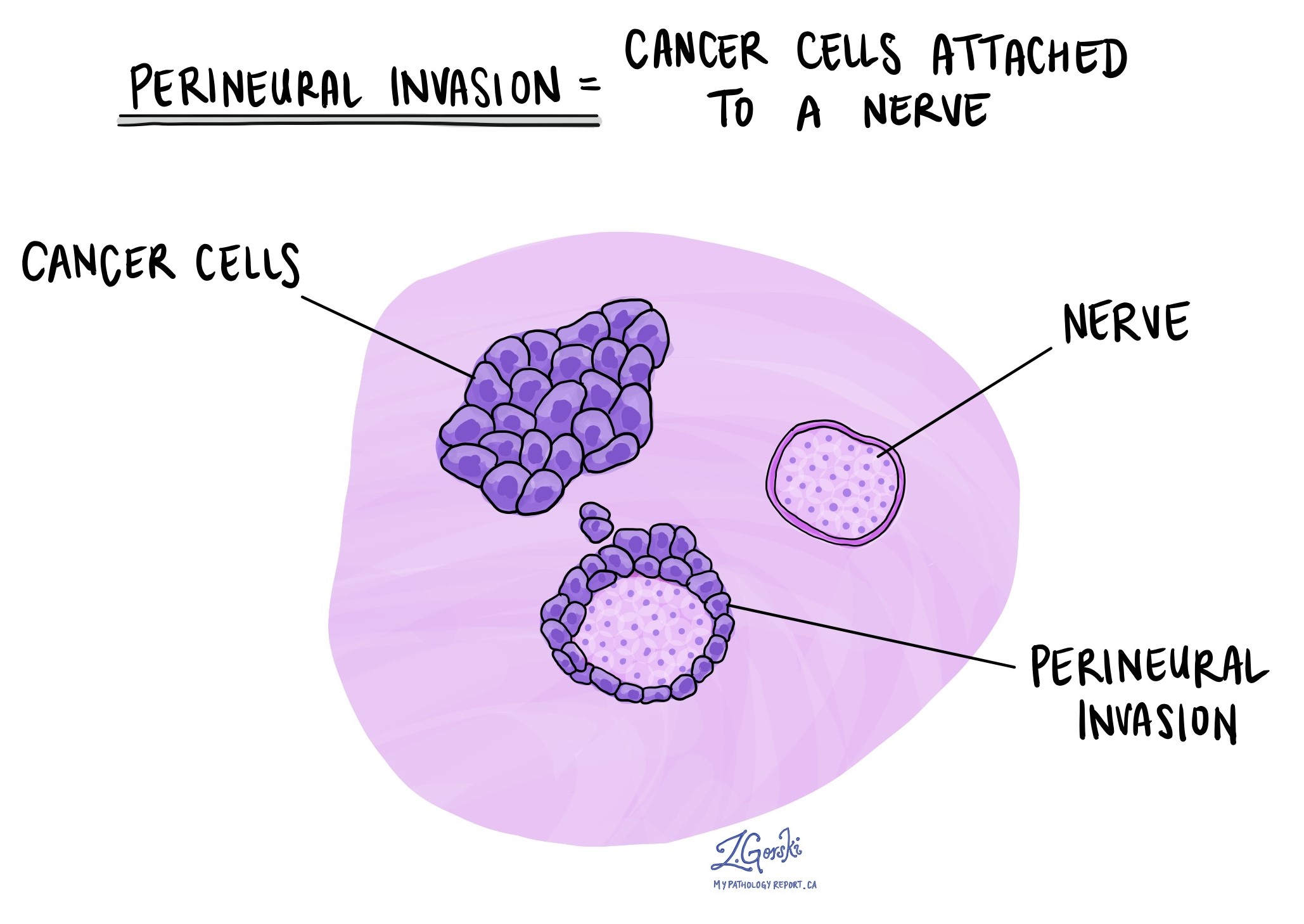
Perineurálna invázia
Patológovia používajú termín „perineurálna invázia“ na opis situácie, keď sa rakovinové bunky prichytia k nervu alebo napadnú nerv. „Intraneurálna invázia“ je príbuzný výraz, ktorý sa špecificky vzťahuje na rakovinové bunky nachádzajúce sa vo vnútri nervu. Nervy, pripomínajúce dlhé drôty, pozostávajú zo skupín buniek známych ako neuróny. Tieto nervy, prítomné v celom tele, prenášajú medzi telom a mozgom informácie, ako je teplota, tlak a bolesť. Prítomnosť perineurálnej invázie je dôležitá, pretože umožňuje rakovinovým bunkám cestovať pozdĺž nervu do blízkych orgánov a tkanív, čím sa zvyšuje riziko recidívy nádoru po operácii.
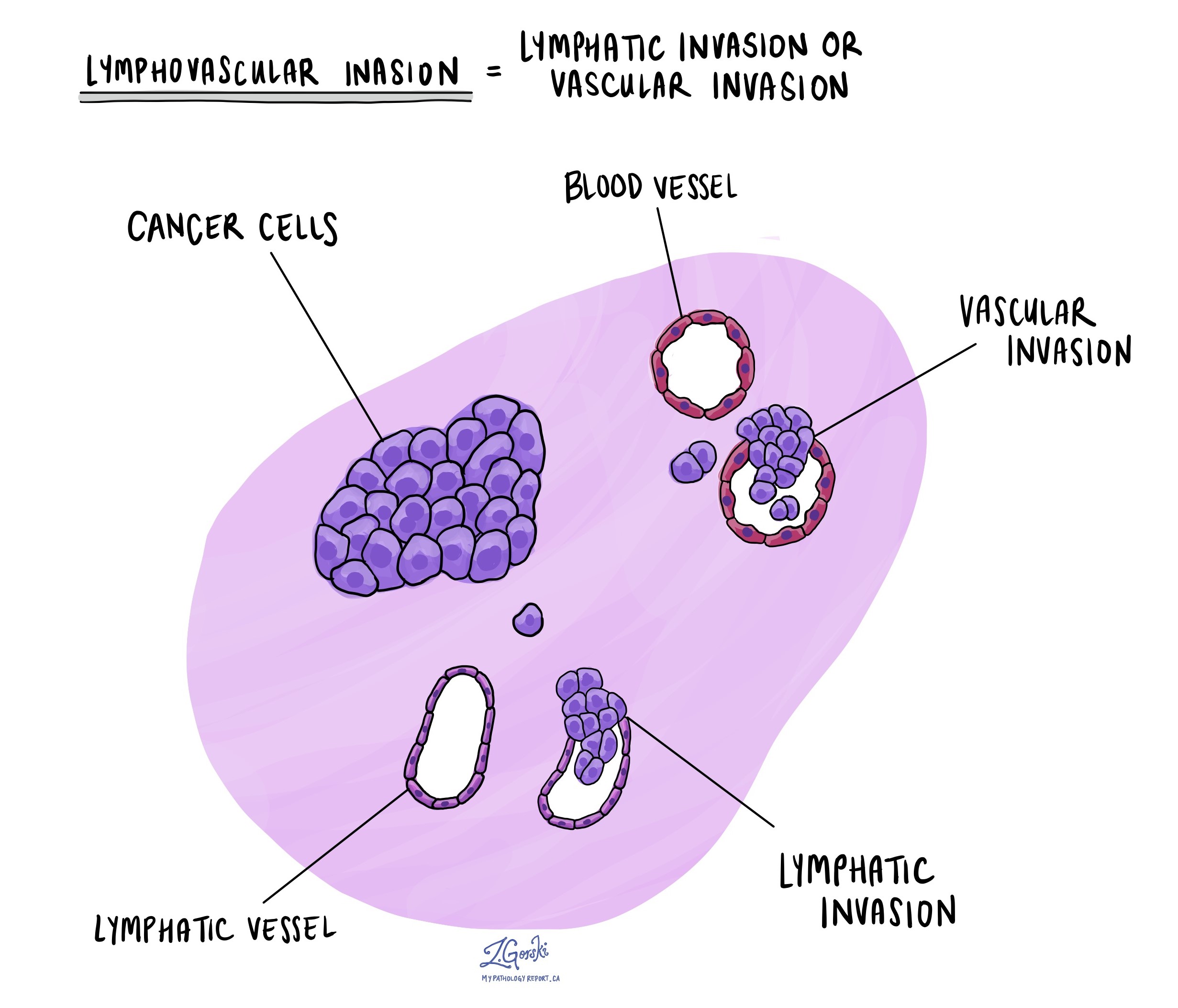
Lymfovaskulárna invázia
Lymfovaskulárna invázia nastáva, keď rakovinové bunky napadnú krvnú cievu alebo lymfatickú cievu. Krvné cievy sú tenké trubice, ktoré prenášajú krv po celom tele, zatiaľ čo lymfatické cievy nesú tekutinu nazývanú lymfa namiesto krvi. Tieto lymfatické cievy sa spájajú s malými imunitnými orgánmi roztrúsenými po celom tele, tzv lymfatické uzliny.
Lymfovaskulárna invázia je dôležitá, pretože umožňuje rakovinovým bunkám šíriť sa do iných častí tela, vrátane lymfatických uzlín alebo pečene, cez krv alebo lymfatické cievy. Okrem toho prítomnosť rakovinových buniek vo veľkej žile za stenou hrubého čreva (mimo hrubého zväzku svalov) je spojená s vysokým rizikom, že rakovinové bunky sa nakoniec nájdu v pečeni.
Okraje
V patológii je okraj okrajom tkaniva odstráneného počas operácie nádoru. Stav okraja v správe o patológii je dôležitý, pretože naznačuje, či bol odstránený celý nádor alebo či nejaký zostal. Tieto informácie pomáhajú určiť potrebu ďalšej liečby.
Patológovia zvyčajne hodnotia okraje po chirurgickom zákroku, ako je napr vyrezanie or resekcia, zameraný na odstránenie celého nádoru. Okraje sa zvyčajne nevyhodnocujú po a biopsia, ktorá odstráni len časť nádoru. Počet hlásených okrajov a ich veľkosť - koľko normálneho tkaniva je medzi nádorom a okrajom rezu - sa líšia v závislosti od typu tkaniva a umiestnenia nádoru.
Patológovia skúmajú okraje, aby skontrolovali, či sú na reze tkaniva prítomné nádorové bunky. Pozitívny okraj, kde sa nachádzajú nádorové bunky, naznačuje, že určitá rakovina môže zostať v tele. Naopak, negatívny okraj bez nádorových buniek na okraji naznačuje, že nádor bol úplne odstránený. Niektoré správy tiež merajú vzdialenosť medzi najbližšími nádorovými bunkami a okrajom, aj keď sú všetky okraje negatívne.

Pučanie nádoru
Pučanie nádoru je termín, ktorý patológovia používajú na opis buď jednotlivých rakovinových buniek, alebo malých skupín rakovinových buniek pozorovaných na okraji nádoru. Predpokladá sa, že je to znak toho, že nádor je čoraz menej diferencovaný. Na základe počtu púčikov pozorovaných pod mikroskopom sa pridelí skóre, buď nízke, stredné alebo vysoké. Vysoké skóre je spojené so zvýšeným rizikom, že sa rakovinové bunky rozšíria do inej časti tela.
Účinok liečby
Ak ste podstúpili liečbu rakoviny (buď chemoterapiu alebo radiačnú terapiu alebo oboje) pred odstránením nádoru, váš patológ starostlivo vyšetrí oblasť tkaniva, kde bol predtým identifikovaný nádor, aby zistil, či sú nejaké rakovinové bunky stále živé (životaschopné). Najčastejšie používaný systém popisuje účinok liečby na stupnici od 0 do 3, pričom 0 znamená žiadne životaschopné rakovinové bunky (všetky rakovinové bunky sú mŕtve) a 3 predstavuje rozsiahlu reziduálnu rakovinu bez zjavnej regresie nádoru (všetky alebo väčšina rakovinové bunky sú živé).
Nádorové ložisko
Nádorové ložisko je skupina rakovinových buniek, ktoré sú oddelené od hlavného nádoru, ale nie v a lymfatická uzlina. Nádorové ložiská sú spojené s vyšším rizikom, že sa nádorové bunky po liečbe rozšíria do inej časti tela, ako je pečeň alebo pľúca. Nádorové depozity tiež určujú patologické štádium nádoru (pT).
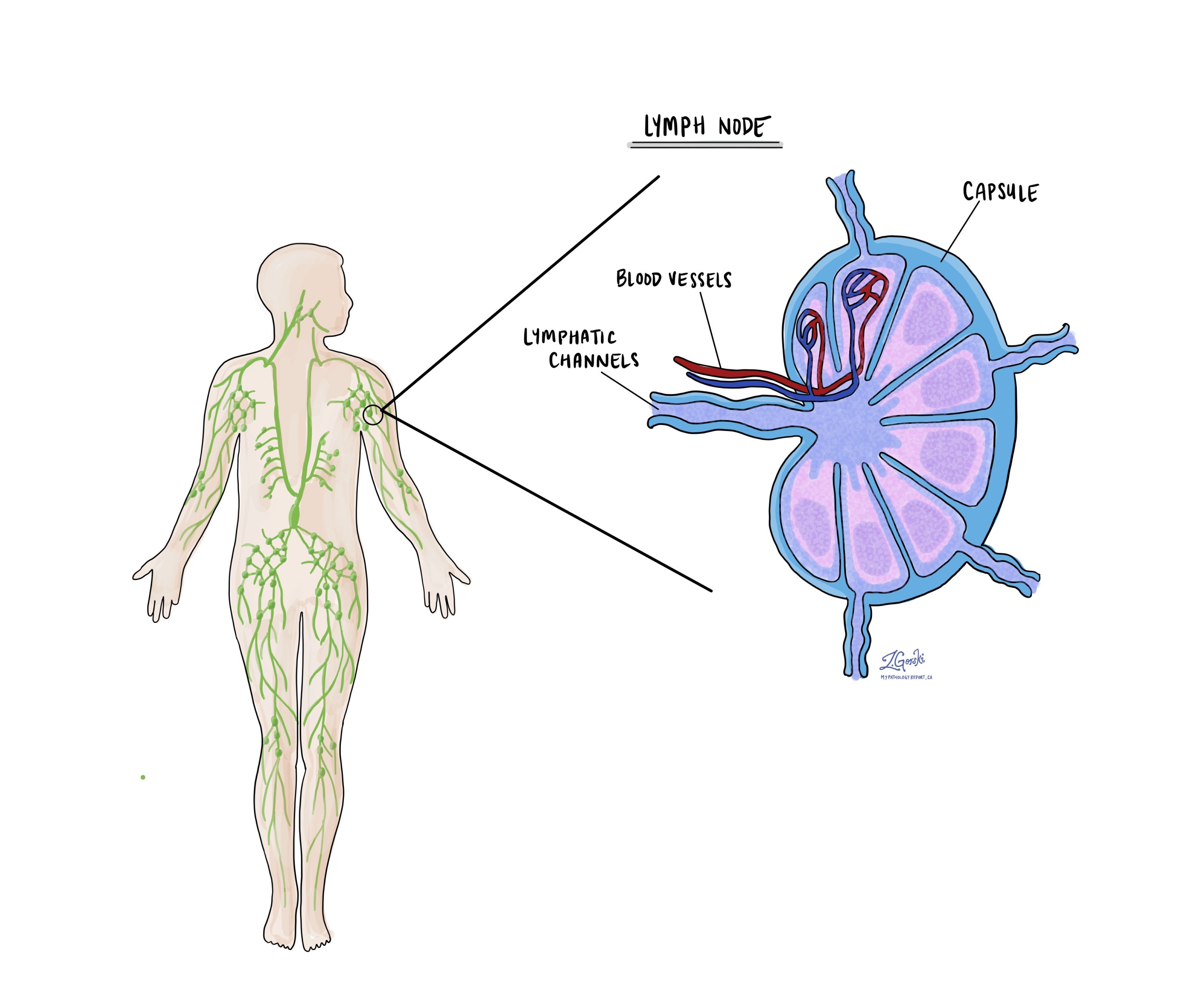
Lymfatické uzliny
Malé imunitné orgány, tzv lymfatické uzliny, sa nachádzajú v celom tele. Rakovinové bunky môžu cestovať z nádoru do týchto lymfatických uzlín cez drobné lymfatické cievy. Z tohto dôvodu lekári často odstraňujú a mikroskopicky skúmajú lymfatické uzliny, aby hľadali rakovinové bunky. Tento proces, pri ktorom sa rakovinové bunky presúvajú z pôvodného nádoru do inej časti tela, ako je lymfatická uzlina, sa nazýva metastáza.
Rakovinové bunky zvyčajne najskôr migrujú do lymfatických uzlín v blízkosti nádoru, hoci môžu byť postihnuté aj vzdialené lymfatické uzliny. V dôsledku toho chirurgovia zvyčajne najskôr odstraňujú lymfatické uzliny najbližšie k nádoru. Môžu odstrániť lymfatické uzliny ďalej od nádoru, ak sú zväčšené a existuje silné podozrenie, že obsahujú rakovinové bunky.
Patológovia preskúmajú všetky odstránené lymfatické uzliny pod mikroskopom a zistenia budú podrobne uvedené vo vašej správe. „Pozitívny“ výsledok znamená prítomnosť rakovinových buniek v lymfatických uzlinách, zatiaľ čo „negatívny“ výsledok znamená, že neboli nájdené žiadne rakovinové bunky. Ak správa nájde rakovinové bunky v lymfatických uzlinách, môže tiež špecifikovať veľkosť najväčšieho zhluku týchto buniek, ktorý sa často označuje ako „focus“ alebo „depozit“. Extranodálne rozšírenie nastáva, keď nádorové bunky prenikajú do vonkajšieho puzdra lymfatickej uzliny a šíria sa do susedného tkaniva.
Vyšetrenie lymfatických uzlín je dôležité z dvoch dôvodov. Po prvé, pomáha určiť patologické uzlové štádium (pN). Po druhé, objavenie rakovinových buniek v lymfatických uzlinách naznačuje zvýšené riziko neskoršieho nájdenia rakovinových buniek v iných častiach tela. Tieto informácie vedú vášho lekára pri rozhodovaní, či potrebujete ďalšie liečby, ako je chemoterapia, rádioterapia alebo imunoterapia.
Mismatch repair proteíny
Mismatch repair (MMR) je systém vo všetkých normálnych, zdravých bunkách, ktorý opravuje chyby v našom genetickom materiáli (DNA). Systém sa skladá z rôznych proteínov a štyri najbežnejšie sú MSH2, MSH6, MLH1 a PMS2.
Štyri chybné opravné proteíny MSH2, MSH6, MLH1 a PMS2 pracujú v pároch na opravu poškodenej DNA. Konkrétne MSH2 spolupracuje s MSH6 a MLH1 pracuje s PMS2. Ak dôjde k strate jedného proteínu, pár nemôže normálne fungovať a zvyšuje sa riziko vzniku rakoviny.
Ako patológovia testujú proteíny na opravu nesúladu?
Najbežnejším spôsobom testovania proteínov na opravu nesúladu je imunohistochémia. Tento test umožňuje patológom zistiť, či nádorové bunky produkujú všetky štyri chybné opravné proteíny. Výsledky tohto testu sa zvyčajne uvádzajú takto:
- Normálny výsledok: Zachovaná expresia proteínu.
- Abnormálny výsledok: Strata expresie bielkovín.
Prečo je testovanie proteínov na opravu nesúladu dôležité?
Testovanie opravy nesúladu je dôležité, pretože môže pomôcť predpovedať, ako dobre môžu niektoré liečby fungovať. Napríklad rakoviny so stratou expresie chybného opravného proteínu budú s väčšou pravdepodobnosťou reagovať na imunoterapeutické liečby, ako sú inhibítory PD-1 alebo PD-L1. Je to preto, že vysoký počet mutácií, ktoré sa často nachádzajú v nedostatočných nádoroch, môže produkovať nové antigény, vďaka ktorým je nádor viditeľnejší a zraniteľnejší voči imunitnému systému.
Testovanie opravy nesúladu sa vykonáva aj na identifikáciu pacientov, ktorí môžu mať Lynchov syndróm, známy aj ako dedičný nepolypózny kolorektálny karcinóm (HNPCC). Lynchov syndróm je genetická porucha, ktorá zvyšuje riziko vzniku rôznych typov rakoviny, vrátane rakoviny pažeráka, rakoviny hrubého čreva, rakoviny endometria, rakoviny vaječníkov a rakoviny žalúdka.
Ďalšie genetické zmeny zistené pri invazívnom adenokarcinóme hrubého čreva a konečníka
- Mutácie génu APC (Adenomatous Polyposis Coli): Mutácie v géne APC, ktoré sú takmer všadeprítomné v sporadických prípadoch rakoviny hrubého čreva, sú často ranou udalosťou vo vývoji kolorektálneho karcinómu. APC gén je tumor supresorový gén a jeho inaktivácia vedie k abnormálnemu rastu buniek.
- Mutácie KRAS a NRAS: Mutácie v génoch KRAS a NRAS, ktoré sú súčasťou rodiny génov RAS, sa vyskytujú približne u 40 – 45 % kolorektálnych karcinómov. Tieto mutácie vedú k nekontrolovanému deleniu a rastu buniek. Najmä prítomnosť mutácií KRAS je spojená s rezistenciou voči určitým terapiám anti-EGFR (receptor epidermálneho rastového faktora).
- Mutácie BRAF: Mutácia génu BRAF, najmä V600E, sa nachádza v približne 10 % kolorektálnych karcinómov. Často sa spája so zlou prognózou a rezistenciou na niektoré terapie. Mutácie BRAF sú bežnejšie pri rakovinách, ktoré sa vyvinuli vrúbkovanou dráhou.
- Mutácie PIK3CA: Mutácie v géne PIK3CA, ktorý kóduje podjednotku fosfatidylinozitol 3-kinázy (PI3K), sa vyskytujú približne u 10 – 20 % kolorektálnych karcinómov. Tieto mutácie môžu aktivovať signálnu dráhu AKT, čím podporujú bunkovú proliferáciu a prežitie.
Testy používané na zistenie genetických zmien
- Sekvenovanie novej generácie (NGS): NGS umožňuje simultánne vyšetrenie viacerých génov na detekciu mutácií, delécií a amplifikácií. Tento komplexný prístup môže posúdiť všetky bežné genetické zmeny pri kolorektálnom karcinóme vrátane mutácií APC, KRAS, NRAS, BRAF a PIK3CA.
- Polymerázová reťazová reakcia (PCR): Táto technika amplifikuje segmenty DNA, čo umožňuje analyzovať špecifické genetické zmeny, ako sú mutácie KRAS, NRAS a BRAF.
- Fluorescenčná in situ hybridizácia (FISH): FISH dokáže identifikovať genetické abnormality, ako sú amplifikácie alebo delécie v špecifických génoch. Menej bežne sa používa na rutinnú detekciu uvedených genetických zmien, ale môže byť nápomocný v špecifických kontextoch.
O tomto článku
Lekári napísali tento článok, aby vám pomohol prečítať a pochopiť vašu správu o patológii. Kontaktujte nás ak máte otázky týkajúce sa tohto článku alebo správy o vašej patológii. Ak chcete získať úplný úvod do správy o vašej patológii, prečítajte si tento článok.