Jason Wasserman MD PhD FRCPC és Zuzanna Gorski MD
Március 27, 2024
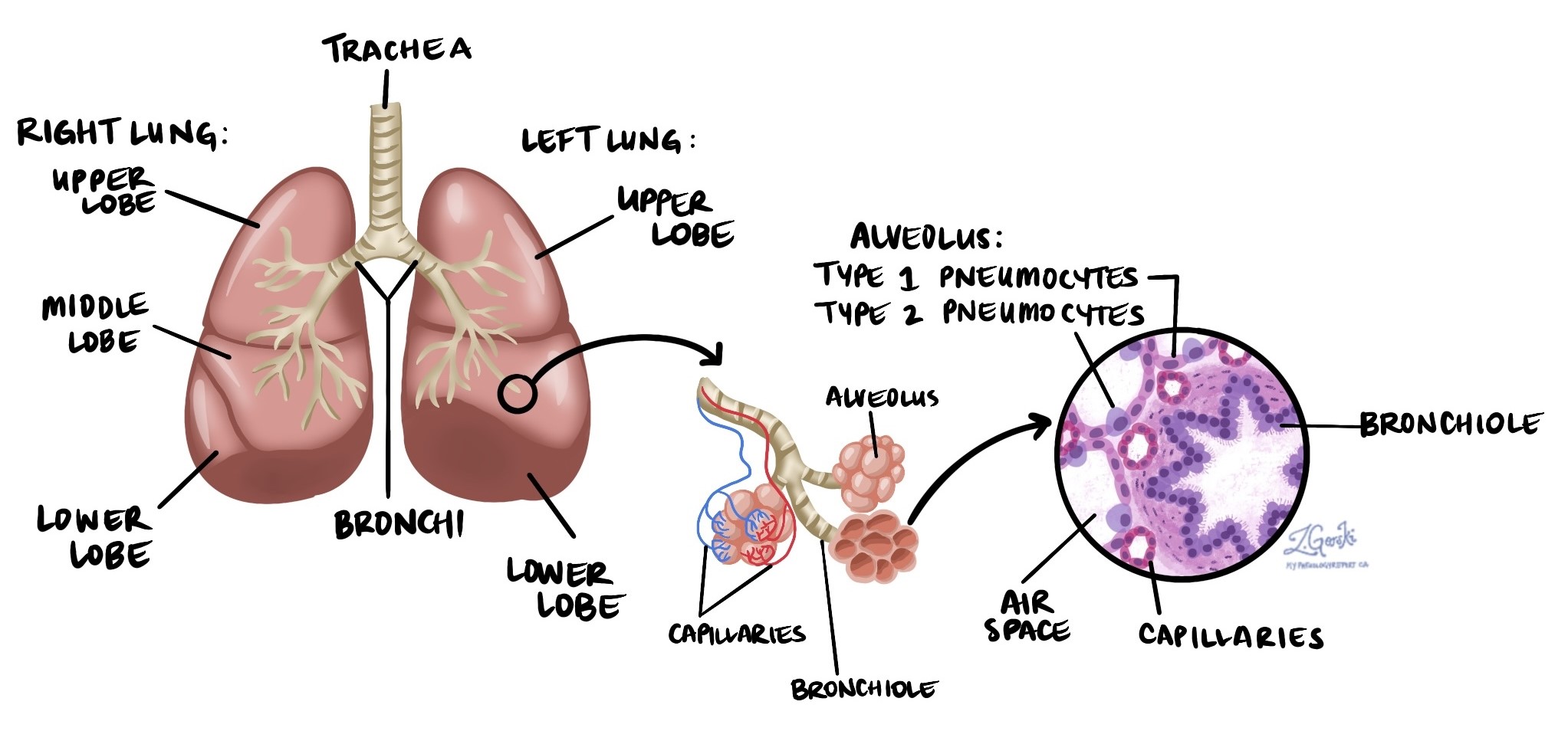
Az adenokarcinóma a tüdőrák leggyakoribb típusa. Észak-Amerikában az összes tüdőrákos eset körülbelül 40%-át teszi ki. Az adenokarcinóma a nem kissejtes tüdőrák (NSCLC) egyik típusa, amely a tüdőrákok leggyakrabban diagnosztizált kategóriája. Az adenokarcinóma specializálódott sejtekből, úgynevezett pneumocitákból indul ki. Ezek a sejtek az alveolusoknak nevezett apró léghólyagok belső nyálkahártyáján találhatók. Az alveolusok a tüdőben lévő kis légterek, ahol az oxigén bejut a vérbe, és a szén-dioxid eltávozik. Mivel az adenokarcinóma gyakran a tüdő szélei közelében kezdődik, korai stádiumban felfedezhető képalkotó vizsgálatok, például röntgen vagy CT-vizsgálatok során.
Mi okozza az adenokarcinómát a tüdőben?
Az adenokarcinóma vezető oka a dohányzás. Egyéb kevésbé gyakori okok közé tartozik a radon expozíció, a foglalkozási ágensek és a kültéri levegőszennyezés.
Milyen tünetei vannak az adenokarcinómának a tüdőben?
A tüdő adenokarcinóma tünetei közé tartozik a tartós vagy súlyosbodó köhögés, a vérköpés, a mellkasi fájdalom és a légszomj. A test más részeire átterjedt daganatok további tüneteket okozhatnak a testben elfoglalt helyüktől függően. Például a csontokba átterjedt daganatok csontfájdalmat okozhatnak, és a csont törését is okozhatják. Az orvosok ezt kóros betegségként írják le. törés.
Milyen állapotok társulnak a tüdő adenokarcinómájához?
Sok esetben az adenokarcinóma egy atípusos adenomatózus hiperplázia (AAH) nevű rákmegelőző betegségből indul ki. Az atípusos adenomatózus hiperplázia sejtjei rendellenesnek tűnnek, de még nem rákos sejtek. Idővel az AAH súlyosabb állapotba, az úgynevezett ... adenokarcinóma in situ (AIS)Ez az állapot nem invazív tüdőráknak számít, mivel a kóros sejtek csak a légutak belső felszínén láthatók, és a növekedés mérete kisebb, mint 3 centiméter. Az in situ adenokarcinóma invazív adenokarcinómává válik, ha a rákos sejtek átterjednek a tüdőre. stroma a légtér felszíne alatt, vagy ha a daganat 3 centiméternél nagyobbra nő.
Hogyan készül ez a diagnózis?
A tüdő adenokarcinóma kezdeti diagnózisa a következő: jellemzően egy kis szövetminta eltávolítása után történik egy úgynevezett eljárás során biopszia or Finom tű szívás (FNA). Ezután műtéttel eltávolítható a teljes daganat. A daganat eltávolítására elvégzett műtét típusa a daganat méretétől és a tüdőben való elhelyezkedésétől függ. Az ékreszekciót általában a kis daganatok és a tüdő külső része közelében lévő daganatok eltávolítására végzik. A lobektómiát és a pneumonectomiát nagy daganatok vagy a tüdő közepéhez közeli daganatok esetén végezzük.
A tüdő adenokarcinóma szövettani típusai
A tüdő adenokarcinómáját szövettani típusokba sorolják a növekedési mintázat, a rákos sejtek összetapadásának módja és a kialakult struktúrák alapján. Az adenokarcinóma leggyakoribb szövettani típusai a lepidikus, szolid, acináris, papilláris és mikropapilláris adenokarcinóma.
Egy daganat csak egyetlen növekedési mintázatot, vagy több növekedési mintázatot is mutathat ugyanabban a daganatban. Ha több növekedési mintázatot figyelnek meg, a legtöbb patológus leírja az egyes mintázatok százalékos arányát a daganatban. A domináns minta a daganat nagy részét alkotó szövettani típus.
Lepidikus minta
A lepidikus típusú tüdőadenokarcinóma olyan rákos sejtekre utal, amelyek a légterek belső nyálkahártyája, az úgynevezett alveolusok mentén nőnek. A rákos sejtek növekedésük során felváltják a normál pneumocitákat. Ez az adenokarcinóma leggyakoribb szövettani típusa. Ha a daganat mérete kisebb, mint 3 cm, és teljes egészében lepidikus növekedési mintázatot mutat, akkor ... adenokarcinóma in situ.
Acinar minta
Az acináris típusú tüdőadenokarcinóma egy olyan ráktípusra utal, amelyben a rákos sejtek kis, kerek sejtcsoportokat alkotnak, amelyek közepén egy nyitott tér, az úgynevezett lumen található. Ez az adenokarcinóma második leggyakoribb szövettani típusa.
Szilárd minta
A szilárd típusú tüdőadenokarcinóma egy olyan ráktípusra utal, amelyben a rákos sejtek nagy csoportokat alkotnak, minimális térrel közöttük. Ez a típusú adenokarcinóma agresszívabb, mint a lepidikus és az acináris típusok, és nagyobb valószínűséggel Áttéteket (átterjedt nyirokcsomók.
Papilláris minta
A papilláris típusú tüdőadenokarcinóma egy olyan ráktípusra utal, amelyben a rákos sejtek hosszú, ujjszerű szövetnyúlványokat, úgynevezett papillákat képeznek, amelyek összetapadnak. A papilláris típusú adenokarcinóma általában agresszívebb, mint a lepidikus dominanciájú daganatok, de kevésbé agresszív, mint a szilárd vagy mikropapilláris típusok.
Mikropapilláris minta
A tüdő mikropapilláris típusú adenokarcinómája egy olyan ráktípusra utal, amelyben a rákos sejtek kis csoportokat alkotnak, amelyek egy térben helyezkednek el. Ez az agresszív ráktípus gyakran áttéteket ad (terjed) -re nyirokcsomók és a tüdő más részei.
Tumor fokozat
A tüdő adenokarcinómáját három fokozatra osztják (jól differenciált, közepesen differenciált és rosszul differenciált) a domináns (leggyakoribb) szövettani típus (növekedési minta) és a legrosszabb (vagy legagresszívabb) szövettani típus kombinációja alapján. A tumor fokozata azért fontos, mert jól előrejelzi, hogyan reagál a tumor a kezelésre. Ez a besorolási sémát csak a nem mucinosus tüdőadenokarcinómára (olyan tumorokra, amelyek nem termelnek nagy mennyiségű mucint) alkalmazzák.
A tüdő adenokarcinóma osztályozási rendszere:
- Jól differenciált: Többnyire vagy teljesen lepidás típusú daganat, 20%-nál kevesebb szilárd vagy mikropapilláris növekedéssel.
- Mérsékelten differenciált: Többnyire vagy teljesen acináris vagy papilláris típusú daganat, 20%-nál kevesebb szilárd vagy mikropapilláris növekedéssel.
- Rosszul differenciált: 20%-nál nagyobb szilárd vagy mikropapilláris növekedésű daganat, vagy összetett mirigyekből vagy egyetlen sejtből álló területekkel.
Immunohisztokémia
Immunhisztokémia (IHC) egy olyan teszt, amely lehetővé teszi a patológusok számára, hogy azonosítsák a sejtek által termelt vegyi anyagok, jellemzően fehérjék alapján a specifikus sejttípusokat. Mivel a különböző sejttípusok különböző IHC markereket expresszálnak, a patológusok ezzel a teszttel megkülönböztethetik a különböző típusú rákos megbetegedéseket.
Amikor IHC-t végeznek, a tüdő adenokarcinóma általában a következő eredményeket mutatja:
- TTF-1 – A daganatok 80%-ában pozitív.
- p40 – Negatív.
- CK5 – Negatív.
- Chromogranin – Negatív.
- Szinaptofizin – Negatív.
A légtereken keresztül terjed
A légtereken keresztüli terjedés (STAS) a tüdőrákban megfigyelhető inváziós mintázatot írja le, ahol a rákos sejtek a tumoron kívül a tüdőszövet légtereibe terjednek. A STAS jelenléte a tüdőadenokarcinómában szenvedő betegeknél, különösen a korai stádiumú betegségben szenvedőknél, a kiújulás magasabb kockázatával és a rosszabb teljes túléléssel jár. A STAS felismerése ezért értékes prognosztikai információkkal szolgálhat, és segíthet a kockázatbecslésben.
A patológusok a tumort körülvevő tüdőszövet mikroszkóp alatti gondos vizsgálatával azonosítják a STAS-t. A légterekben lévő tumorsejteket vagy sejtcsoportokat keresik, amelyek elkülönülnek az elsődleges tumortól és nem tapadnak a tumor széléhez, gyakran a tumortömegtől távol helyezkednek el. Ezek a sejtek szabadon lebeghetnek, vagy az alveoláris falakhoz tapadhatnak, de megkülönböztethetők az elsődleges tumortól, és nem magyarázhatók más folyamatokkal, például műtermékekkel vagy... limfovaszkuláris invázió.
Több daganat
Nem ritka, hogy egynél több daganatot találnak ugyanabban a tüdőben. Amikor ez megtörténik, a jelentésben minden daganatot külön ismertetnek.
Egynél több daganat megtalálásának két lehetséges magyarázata van:
- Az egyik daganatból származó daganatsejtek a tüdő másik részére terjedtek. Ez a magyarázat valószínűbb, ha az összes daganat azonos szövettani típusba tartozik. Például, ha az összes daganat acináris típusú adenokarcinóma. Ha a daganatok a test ugyanazon oldalán helyezkednek el, a kisebb daganatokat csomóknak nevezzük. Ha a daganatok a test különböző oldalain helyezkednek el (jobb és bal tüdő), a kisebb daganatot csomónak nevezzük. áttétel.
- A daganatok külön-külön fejlődtek ki. Ez a valószínűbb magyarázat, ha a daganatok különböző szövettani típusúak. Például az egyik daganat adenokarcinóma, míg a másik a laphámsejtes karcinóma. Ebben a helyzetben a daganatok különálló elsődlegesnek minősülnek, nem pedig áttétes betegségnek
Pleurális invázió
A mellhártya egy vékony szövetréteg, amely a tüdőt borítja és a mellkasüreg belső felületét béleli.
Két rétegből áll:
-
Zsigeri mellhártya: A közvetlenül a tüdejéhez kapcsolódó réteg.
-
Parietális mellhártyaA mellkasfalat és a rekeszizmot bélelő réteg.
Amikor a tumorsejtek túlnőnek a tüdőn és behatolnak a mellhártyába, azt pleurális inváziónak nevezik. A mellhártyai invázió azért fontos, mert befolyásolja mind a stádiumbeosztást, mind a prognózist:
-
Tumor stádiumA pleurába behatoló daganatokat előrehaladottabbnak tekintik. A pleurális invázió növeli a daganat T-stádiumát a TNM stádiumbeosztási rendszerben.
-
PrognózisA pleurális invázióval rendelkező betegek prognózisa általában rosszabb, mivel a rák agresszívabb és nagyobb valószínűséggel terjed.
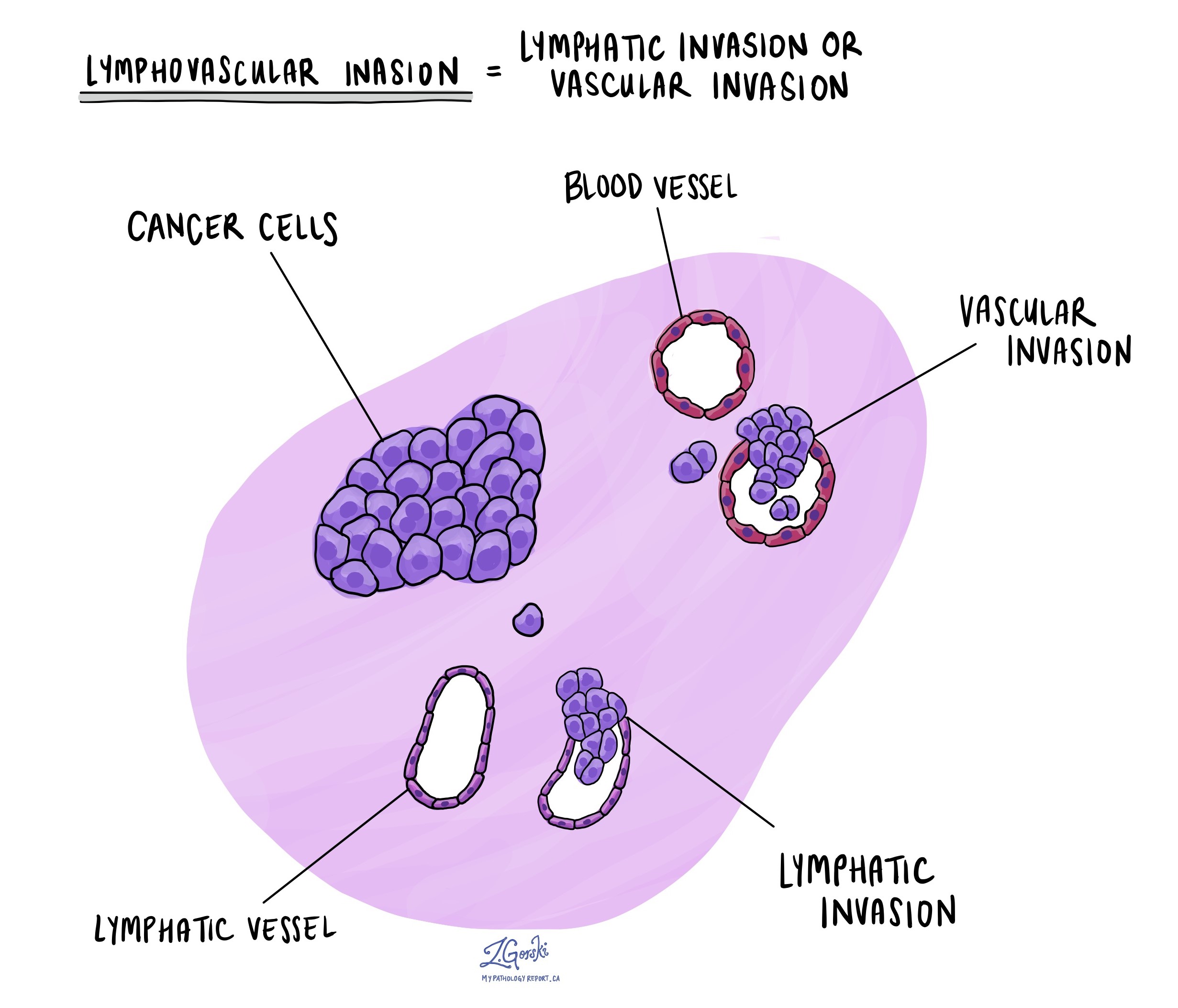
Lymphovascularis invázió
A rákos sejtek átterjedhetnek apró erekbe vagy nyirokcsatornákba, ezt a folyamatot nevezik limfovaszkuláris invázióA vérerek szállítják a vért az egész testben, míg a nyirokcsatornák a nyirokfolyadékot, amely kulcsfontosságú szerepet játszik az immunfunkciókban. Amikor a tumorsejtek bejutnak ezekbe a csatornákba, átterjedhetnek a test más részeire, például nyirokcsomók, a májban vagy a csontokban. A nyirokavaszkuláris invázió felfedezése a rák terjedésének nagyobb kockázatát jelenti.
Margók
A patológiában a szegély a daganat eltávolítására irányuló műtét során eltávolított szövet szélére utal. Tüdőműtét után a patológusok mikroszkóp alatt gondosan megvizsgálják ezeket a szövetszéleket, hogy megállapítsák, a daganatot teljesen eltávolították-e.
A tüdőrák műtétek során értékelt margók jellemzően a következők:
-
Hörgőszél – Itt vágja át a sebész a légutakat.
-
Érrendszeri margin – Ezek azok a területek, ahol a daganat közelében lévő nagy ereket átvágják.
-
Parenchymális margó – Ez a határvonal magában foglalja a daganatot körülvevő tüdőszövet szélét.
-
Pleurális margó – A mellhártya egy vékony bélés, amely körülveszi a tüdőt, és ezt a határt vizsgálják annak megállapítására, hogy a daganat a bélés közelében vagy azon keresztül növekszik-e.
A margókat kétféleképpen lehet leírni:
-
Negatív margó – A vágott széleken nem láthatók rákos sejtek. Ez arra utal, hogy a daganatot valószínűleg teljesen eltávolították, ami a műtét célja.
-
Pozitív margó – A rákos sejtek a szövet vágott szélén láthatók. A pozitív szegély azt jelenti, hogy még lehetnek daganatsejtek a szervezetben. A pozitív szegéllyel rendelkező betegeknek további kezelésekre lehet szükségük, például egy második műtétre vagy sugárterápiára, a megmaradt daganatsejtek eltávolítása és a kiújulás kockázatának csökkentése érdekében.
A szélek állapota segít orvosának meghatározni a további kezelés szükségességét, és fontos szerepet játszik a daganat újbóli növekedésének valószínűségének előrejelzésében.

Nyirokcsomók
Nyirokcsomók apró, bab alakú szervek, amelyek alapvető szerepet játszanak az immunrendszerben. A testben kis csatornákon, úgynevezett nyirokereken keresztül kapcsolódnak egymáshoz. A rákos sejtek a daganatból ezeken a nyirokereken keresztül terjedhetnek a közeli nyirokcsomókba – ezt a folyamatot nyirokcsomó-áttétnek nevezik.
A tüdőben és a mellkasban található nyirokcsomók meghatározott területekre, úgynevezett nyirokcsomó-állomásokra vannak csoportosítva. 14 különböző nyirokcsomó-állomás létezik, mindegyiknek meghatározott helye van:
-
1. állomás: Alsó nyaki, supraclavicularis és sternális bevágásos nyirokcsomók.
-
2. állomás: Felső paratracheális nyirokcsomók.
-
3. állomás: Prevaszkuláris és retrotracheális nyirokcsomók.
-
4. állomás: Alsó paratracheális nyirokcsomók.
-
5. állomás: Subaortikus (aortopulmonális ablak) nyirokcsomók.
-
6. állomás: Para-aorta nyirokcsomók (a felszálló aorta vagy a rekeszizom közelében).
-
7. állomás: Subcarinalis nyirokcsomók (a carina alatt, ahol a légcső hörgőkre ágazik).
-
8. állomás: Paraözofageális nyirokcsomók (a nyelőcső mentén, a carina alatt).
-
9. állomás: Pulmonális szalag nyirokcsomók.
-
10. állomás: Hiláris nyirokcsomók (a tüdő hilumánál, ahol a légutak belépnek a tüdőbe).
-
11. állomás: Interlobáris nyirokcsomók (a tüdőlebenyek között).
-
12. állomás: Lobaris nyirokcsomók (a tüdőlebenyekben).
-
13. állomás: Szegmentális nyirokcsomók (a tüdőszegmenseken belül).
-
14. állomás: Szubszegmentális nyirokcsomók (kisebb tüdő alszegmenseken belül).

Ha a műtét során nyirokcsomókat távolítanak el, a patológus mikroszkóp alatt gondosan megvizsgálja azokat, hogy lássa, tartalmaznak-e rákos sejteket. A patológiai lelet jellemzően a következőket tartalmazza:
-
A vizsgált nyirokcsomók teljes száma.
-
A vizsgált nyirokcsomók helye (állomásai).
-
A rákos sejteket tartalmazó nyirokcsomók száma.
-
A rákos sejtek legnagyobb csoportjának mérete (gyakran „fókusznak” vagy „lerakódásnak” nevezik).
A nyirokcsomó-vizsgálat fontos információkat szolgáltat, amelyek segítenek orvosának meghatározni a rák patológiás nyirokcsomó-stádiumát (pN). Segít megjósolni annak valószínűségét is, hogy a rákos sejtek átterjedtek a test más részeire, irányítva a további kezelésekkel, például kemoterápiával, sugárterápiával vagy immunterápiával kapcsolatos döntéseket.
Patológiás stádium (pTNM)
A patológusok a TNM stádiumbeosztási rendszert használják a rák előrehaladottságának meghatározására és a kezelési döntések meghozatalának elősegítésére.
-
Daganatos (T) stádiumA daganat mérete és a környező szövetek esetleges inváziója alapján.
-
Csomópont (N) szakaszA vizsgált nyirokcsomók száma és a rákos sejteket tartalmazó sejtek száma alapján.
-
Áttét (M) stádiumA rákos sejteknek a test távoli részeire, például a csontokba vagy az agyba való terjedésén alapul.
Mindegyik kategóriához tartozik egy szám; a magasabb számok előrehaladottabb betegséget jelentenek.
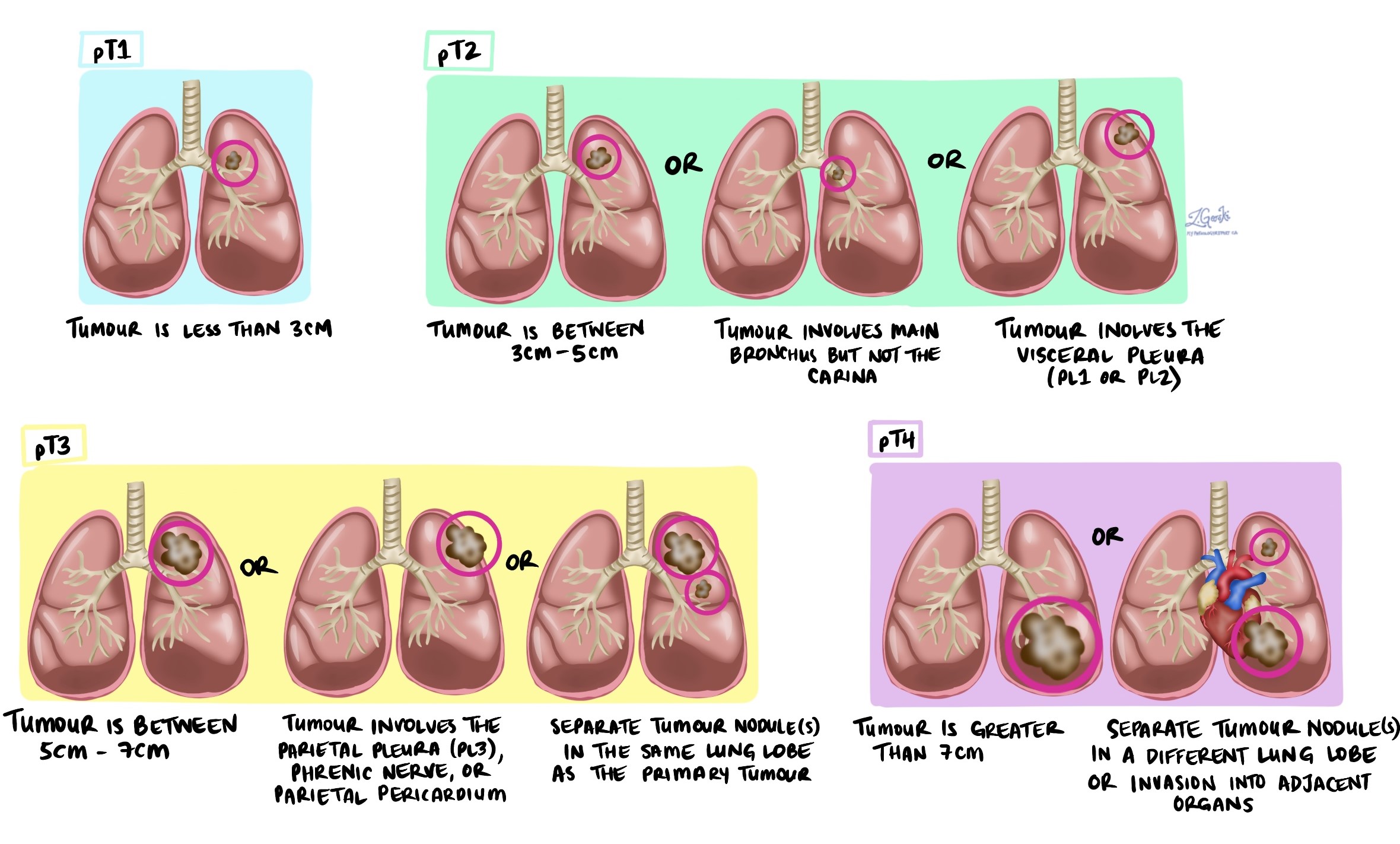
Tumor stádium (pT)
-
T1A daganat mérete 3 cm vagy annál kisebb.
-
T2A daganat mérete meghaladja a 3 cm-t, de nem haladja meg az 5 cm-t, vagy behatolt a zsigeri mellhártyába vagy a fő légutakat.
-
T3A daganat mérete meghaladja az 5 cm-t, de nem haladja meg a 7 cm-t, vagy a környező szövetekbe nőtt.
-
T4A daganat nagyobb, mint 7 cm, vagy megtámadta a közeli szerveket, például a szívet vagy a nyelőcsövet.
Csomóponti szakasz (pN)
-
NXA nyirokcsomókat nem vizsgálták.
-
N0Nincsenek rákos sejtek a nyirokcsomókban.
-
N1Rákos sejtek a tüdő nyirokcsomóiban vagy a légutak közelében (10–14. állomás).
-
N2Rákos sejtek a mellkas központi részén, a légutak közelében található nyirokcsomókban (7–9. állomás).
-
N3Rákos sejtek a mellkas ellentétes oldalán vagy az alsó nyakban található nyirokcsomókban (1–6. állomás).
Metasztatikus stádium (pM)
-
M0Nincs távoli terjedés.
-
M1A rák a test távoli részeire is átterjedt.
-
MXNem állapítható meg, hogy távoli terjedés történt-e.
A tüdő adenokarcinóma biomarkerei
A biomarkerek a tumorsejtekben található specifikus molekulák. Ezek a molekulák segítenek az orvosoknak megérteni, hogyan viselkedik a tumor, és hogyan reagálhat a különböző kezelésekre. A biomarkerek vizsgálata fontos a tüdőrákban, mivel egyes tumorok genetikai változásokat vagy elváltozásokat tartalmaznak, amelyek miatt jól reagálnak a célzott terápiákra. A célzott terápiák olyan gyógyszerek, amelyeket kifejezetten az ilyen genetikai változásokkal rendelkező rákos sejtek megtámadására terveztek. Ezen biomarkerek azonosítása segít az orvosoknak a leghatékonyabb kezelési lehetőségek kiválasztásában.
A patológusok speciális laboratóriumi vizsgálatokkal keresik a biomarkereket. Két gyakori teszt a következő:
-
Következő generációs szekvenálás (NGS) – Ez a teszt egyszerre sok gént vizsgál a mutációk (a tumorsejtek genetikai anyagában bekövetkező változások) megtalálása érdekében. Az NGS egyetlen szövetmintából gyorsan képes több biomarkert azonosítani.
-
Immunhisztokémia (IHC) – Ez a teszt speciális festékeket használ, amelyek a rákos sejtek által termelt specifikus fehérjékhez kötődnek. Amikor ezek a fehérjék jelen vannak, a tumorsejtek színe megváltozik a mikroszkóp alatt. Az IHC segít megerősíteni, hogy bizonyos biomarkerek jelen vannak-e a tumorban.
Tüdőadenokarcinómában tesztelt gyakori biomarkerek
A patológiai lelet a következő biomarkerekről tartalmazhat információkat. Minden biomarker segíthet a kezelés irányításában, és fontos információkat nyújthat a daganatról.
-
EGFR: Az EGFR gén mutációi (változásai) gyakoriak a tüdő adenokarcinómában, különösen a soha nem dohányzó egyéneknél, a nőknél és a kelet-ázsiai származásúaknál. Az EGFR-mutációkat hordozó tumorok gyakran nagyon jól reagálnak a célzott terápiákra, az úgynevezett EGFR-gátlókra. A jelentés EGFR-pozitívként írja le a tumort, ha mutációt találnak. Ha nem találnak mutációt, akkor EGFR-negatívnak fogják nevezni.
-
ALK: Az ALK génben bekövetkező változások, más néven ALK átrendeződések vagy fúziók, daganat növekedéséhez vezetnek, és gyakran megfigyelhetők fiatalabb betegeknél vagy nemdohányzóknál. Az ALK gén átrendeződését mutató daganatok általában jól reagálnak az ALK-gátlóknak nevezett gyógyszerekre. A lelet szerint a daganat ALK-pozitív, ha ez az elváltozás jelen van. Ha nincs jelen, a daganat ALK-negatív lesz.
-
ROS1: A ROS1 átrendeződések (fúziók) a rákos sejtek gyors növekedését okozzák. A ROS1-pozitív tumorok jellemzően jól reagálnak a célzott ROS1-gátló terápiákra. Ha a tumorban ROS1 átrendeződés van, akkor ROS1-pozitívként fogják leírni. Ha nem találnak átrendeződést, akkor ROS1-negatívként fogják leírni.
-
BRAF: A BRAF gén bizonyos mutációi a tumorsejtek gyors növekedését okozhatják. A specifikus BRAF mutációkat, különösen a V600E mutációt hordozó tumorok BRAF-gátlókkal kezelhetők. Ha BRAF mutációt találnak, a tumort BRAF-pozitívnak fogják minősíteni. Ha nem találnak mutációt, akkor BRAF-negatívnak fogják nevezni.
-
TALÁLKOZOTT: A MET gén mutációi, különösen a „MET exon 14 kihagyásához” vezető mutációk, fokozott tumornövekedést okoznak. A MET-pozitív tumorok gyakran reagálnak a MET-gátlóként ismert célzott terápiákra. A patológiai lelet MET-pozitívként írja le a tumort, ha ez a mutáció jelen van. Ha nem találnak mutációt, a tumor MET-negatív lesz.
-
RET: A RET-átrendeződések vagy -fúziók kontrollálatlan tumornövekedést eredményeznek. A RET-fúzióval rendelkező tumorok általában nagyon jól reagálnak a RET-gátlókra. A jelentés szerint a tumor RET-pozitív, ha fúziót találnak. Ha nem találnak fúziót, akkor RET-negatívként fogják leírni.
-
NTRK1-3: Az NTRK génfúziók ritkák, de erősen elősegíthetik a daganat növekedését. Az NTRK fúzióval rendelkező daganatok általában reagálnak a TRK-gátlóként ismert célzott gyógyszerekre. Ha NTRK fúziót észlelnek, a daganatot NTRK-pozitívnak minősítik. Ha nem, akkor NTRK-negatívnak.
-
KRAS: A KRAS-mutációk gyakoriak a tüdő adenokarcinómákban, különösen a dohányosok körében. Korábban a KRAS-pozitív tumorokat nehéz volt kezelni, de a legújabb, egy specifikus KRAS-mutációt (KRAS G12C) célzó gyógyszerek ígéretes eredményeket mutattak. Ha KRAS-mutáció van jelen, a tumort KRAS-pozitívként fogják leírni. Ha nem mutatható ki mutáció, a tumor KRAS-negatív.
-
ERBB2 (HER2): Az ERBB2 mutációk (más néven HER2 mutációk) elősegíthetik a daganat növekedését, különösen a nemdohányzóknál. A HER2 mutációt hordozó daganatok reagálhatnak a jelenleg vizsgálat alatt álló vagy speciális központokban elérhető célzott terápiákra. Ha a daganat ERBB2 mutációval rendelkezik, akkor ERBB2-pozitívként fogják leírni. Ha nem találnak mutációt, akkor ERBB2-negatívként fogják leírni.
-
NRAS: Az NRAS gén mutációi leggyakrabban dohányzó emberek daganataiban fordulnak elő. Jelenleg az NRAS mutációkra specifikus célzott terápiák korlátozottak; azonban a mutáció azonosítása továbbra is segíthet a daganat viselkedésének megértésében. A daganatot NRAS-pozitívnak minősítik, ha mutációt találnak, és NRAS-negatívnak, ha nincs jelen mutáció.
-
MAP2K1 (MEK1): A MAP2K1 mutációk gyakoribbak a dohányosok körében, és fokozott tumornövekedéssel járnak. Jelenleg a MAP2K1 mutációkat célzó kezeléseket még tanulmányozzák. A patológiai leletből kiderül, hogy jelen van-e MAP2K1 mutáció (MAP2K1-pozitív) vagy sem (MAP2K1-negatív).
-
NRG1: Az NRG1 génátrendeződések ritkák, de jelentősek, mivel elősegíthetik a tumor gyors növekedését. A kutatók aktívan vizsgálják az NRG1 átrendeződéssel rendelkező tumorok célzott kezelési módjait. A tumort NRG1-pozitívnak minősítik, ha ezt az átrendeződést megtalálják. Ha nem találják meg, akkor NRG1-negatívnak.
Miért fontosak a biomarker tesztek a kezelés szempontjából?
Ezen biomarkerek azonosítása a daganatban elengedhetetlen, mivel segítenek az orvosoknak a leghatékonyabb kezelések kiválasztásában. Egyes biomarkerek olyan specifikus gyógyszerekhez kapcsolódnak, amelyek közvetlenül a daganatsejteket célozzák. Ezek a kezelések gyakran jobban működnek és kevesebb mellékhatással járnak, mint a hagyományos kemoterápia.
Ha a daganatod nem rendelkezik olyan biomarkerekkel, amelyek megfelelnének a rendelkezésre álló célzott kezeléseknek, orvosod más lehetőségeket is javasolhat, például kemoterápiát vagy immunterápiát. Orvosi csapatod segít megérteni a teszteredményeidet és a számodra elérhető legjobb kezelési lehetőségeket.
Kezelési hatás
A kezelés hatását a jelentés csak akkor írja le, ha Ön kemoterápiában vagy sugárterápiában részesült a daganat eltávolítására irányuló műtét előtt. A kezelés hatásának meghatározásához patológusa megméri az élő (életképes) daganat mennyiségét, és ezt a számot az eredeti daganat százalékában fejezi ki. Például, ha a patológus 1 cm-es életképes daganatot talál, és az eredeti daganat 10 cm-es volt, az életképes daganat százalékos aránya 10%.