Jason Wasserman MD PhD FRCPC ja Zuzanna Gorski MD
Jaanuar 15, 2024
Invasiivne adenokartsinoom (tuntud ka kui käärsoole adenokartsinoom) on kõige levinum käärsoolevähi tüüp. See koosneb rakkudest, mis tavaliselt katavad käärsoole sisepinda. Seda tüüpi vähk algab sageli polüüpist, näiteks a torukujuline adenoom, tubulovilloosne adenoomvõi villiline adenoom.
See artikkel aitab teil mõista käärsoole invasiivse adenokartsinoomi diagnoosi ja patoloogiaaruannet.
Käärsool
Käärsool on osa seedesüsteemist ja jämesoole esimene osa. See on pikk õõnes toru, mis algab peensoole lõpust ja lõpeb pärasooles. Käärsool jaguneb neljaks osaks: tõusev (paremal), põiki, laskuv (vasak) ja sigmoidne. See mängib olulist rolli jääkainete töötlemisel ning vee, elektrolüütide ja mõnede vitamiinide imendumisel. Invasiivne adenokartsinoom võib tekkida käärsoole mis tahes osas.
Mis põhjustab käärsoole invasiivset adenokartsinoomi?
Arvatakse, et käärsoole invasiivne adenokartsinoom on põhjustatud keskkonna- ja geneetiliste tegurite kombinatsioonist. Väljakujunenud riskitegurid hõlmavad töödeldud liha, punase liha ja alkoholi liigset tarbimist. Liigse keharasvaga inimestel on ka suurem risk seda tüüpi vähki haigestuda. Pikendatud põletik käärsooles, mida võib täheldada põletikulise soolehaiguse (haavandiline koliit ja Crohni tõbi) korral, seostatakse ka suurenenud riskiga invasiivse adenokartsinoomi tekkeks.
Millised on käärsoole invasiivse adenokartsinoomi sümptomid?
Invasiivse adenokartsinoomi sümptomid sõltuvad kasvaja asukohast käärsooles. Kasvajad vasakpoolses käärsooles (kahanev käärsool) või pärasooles võivad põhjustada muutusi väljaheites, verist väljaheidet, kõhuvalu või puhitus. Kasvajad paremas käärsooles (tõusev käärsool) ei pruugi mingeid sümptomeid põhjustada enne, kui kasvaja on väga suur või levinud teistesse kehaosadesse.
Kust käärsooles algab invasiivne adenokartsinoom?
Käärsoole invasiivne adenokartsinoom tekib epiteelirakud tavaliselt leidub käärsoole sisepinnal. Need epiteelirakud ühenduvad moodustades struktuure, mida nimetatakse näärmed. Näärmed koos nende all oleva lamina propria ja muscularis mucosaega moodustavad õhukese koekihi, mida nimetatakse limaskestaks. Kui kasvajarakud paiknevad täielikult limaskesta sees, nimetatakse seda seisundit kõrge astme düsplaasia.
Kõrge astme düsplaasiat peetakse mitteinvasiivseks vähieelseks seisundiks ja kasvajarakud ei saa seda teha metastaasideks (levi) teistele kehaosadele. Kuid kui kasvaja kasvab ja rakud tungivad koe aluskihtidesse, muutub diagnoos invasiivseks adenokartsinoomiks. Erinevalt kõrge astme düsplaasiast võivad invasiivse kartsinoomi kasvajarakud metastaaseeruda (levida) lümfisõlmed ja muud kehaosad.

Selle kasvaja mikroskoopilised tunnused
Mikroskoopilisel uurimisel koosneb käärsoole invasiivne adenokartsinoom ebanormaalsete rühmadest epiteelirakud tavaliselt alati muutumatu suurusega näärmed (mis võib välja näha sarnane käärsoole tavaliste näärmetega), pesad või lehed.
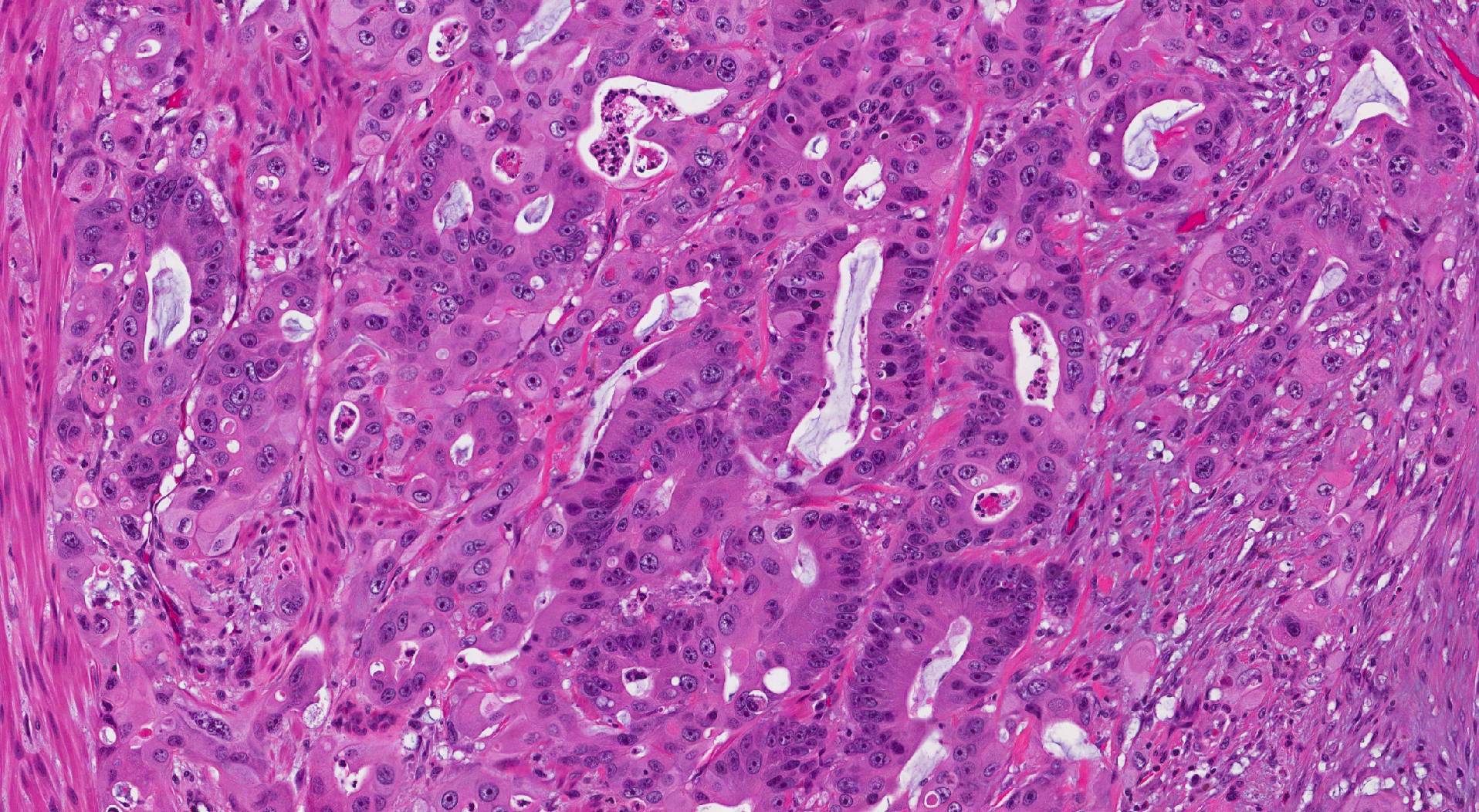
Mida otsida oma patoloogiaaruandest käärsoole invasiivse adenokartsinoomi kohta:
Limaskesta diferentseerumine
Patoloogid kasutavad terminit limaskestade diferentseerumine, et kirjeldada kasvajaid, mis sisaldavad suures koguses rakuvälist mutsiin. Mutsiin on spetsiaalne valgu tüüp, mida toodavad nii normaalsed rakud kui ka kasvajarakud. Ekstratsellulaarne tähendab, et mutsiini nähti väljaspool kasvajarakke. Kui rohkem kui 50% kasvajast koosneb mutsiinist, nimetatakse kasvajat limaskestade adenokartsinoom.
Histoloogiline hinne
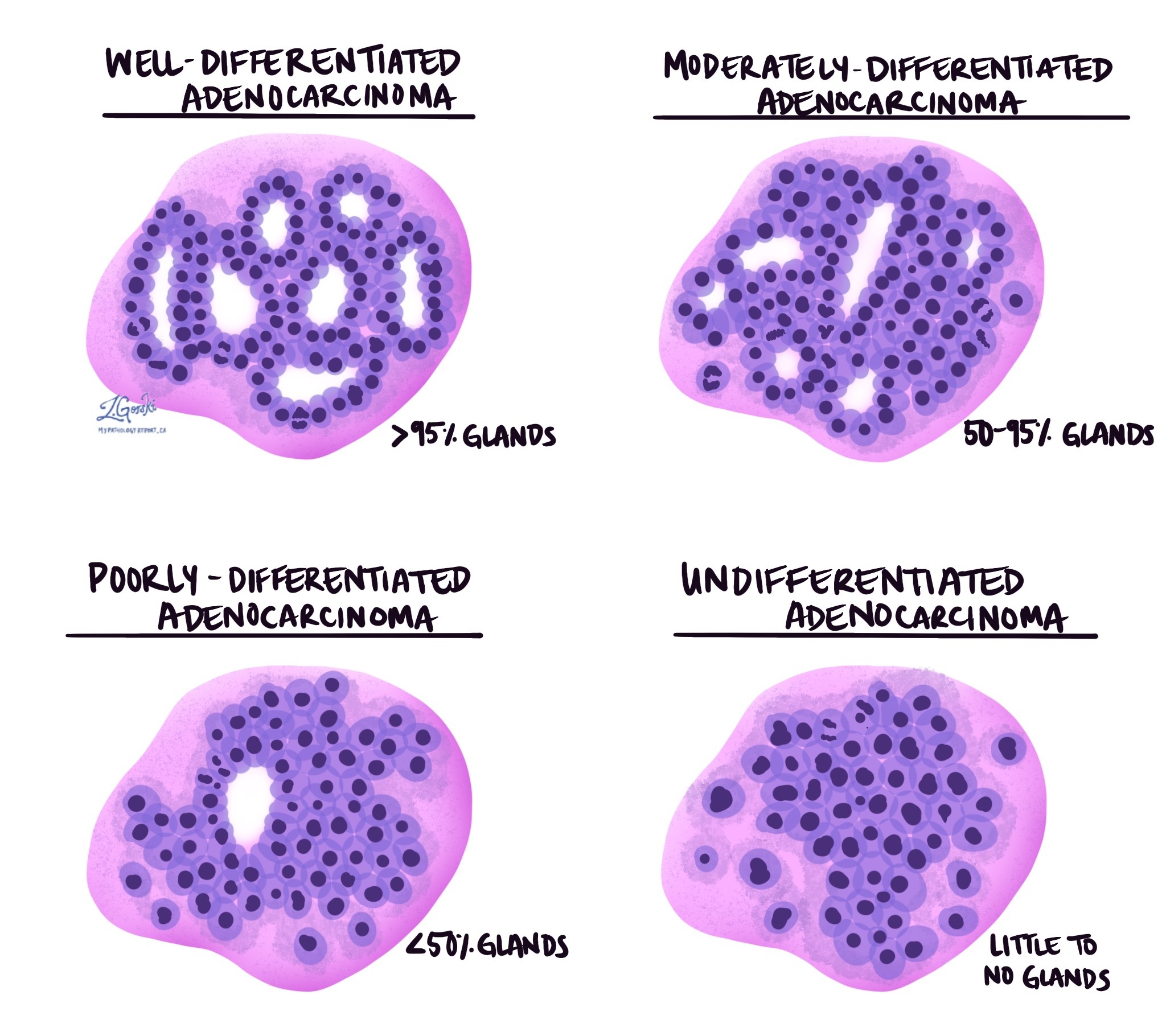
Invasiivne käärsoole adenokartsinoom jaguneb kolmeks astmeks - hästi diferentseeritud, mõõdukalt diferentseeritud ja halvasti diferentseeritud. Hinne põhineb kasvajarakkude protsendil, mis moodustavad ümaraid struktuure nn näärmed. Kasvajat, mis ei moodusta näärmeid, nimetatakse diferentseerumata. Hinne on oluline, sest halvasti diferentseerunud ja diferentseerumata kasvajad kipuvad käituma agressiivsemalt; näiteks levivad need kasvajad tõenäolisemalt edasi lümfisõlmed ja muud kehaosad.
- Hästi diferentseeritud: enam kui 95% kasvajast koosneb näärmetest. Patoloogid kirjeldavad neid kasvajaid ka 1. astmena.
- Mõõdukalt diferentseeritud: 50–95% kasvajast koosneb näärmetest. Patoloogid kirjeldavad neid kasvajaid ka 2. astmena.
- Halvasti diferentseeritud: vähem kui 50% kasvajast koosneb näärmetest. Patoloogid kirjeldavad neid kasvajaid ka 3. astmena.
- Diferentseerumata: kasvajas on näha väga vähe näärmeid.
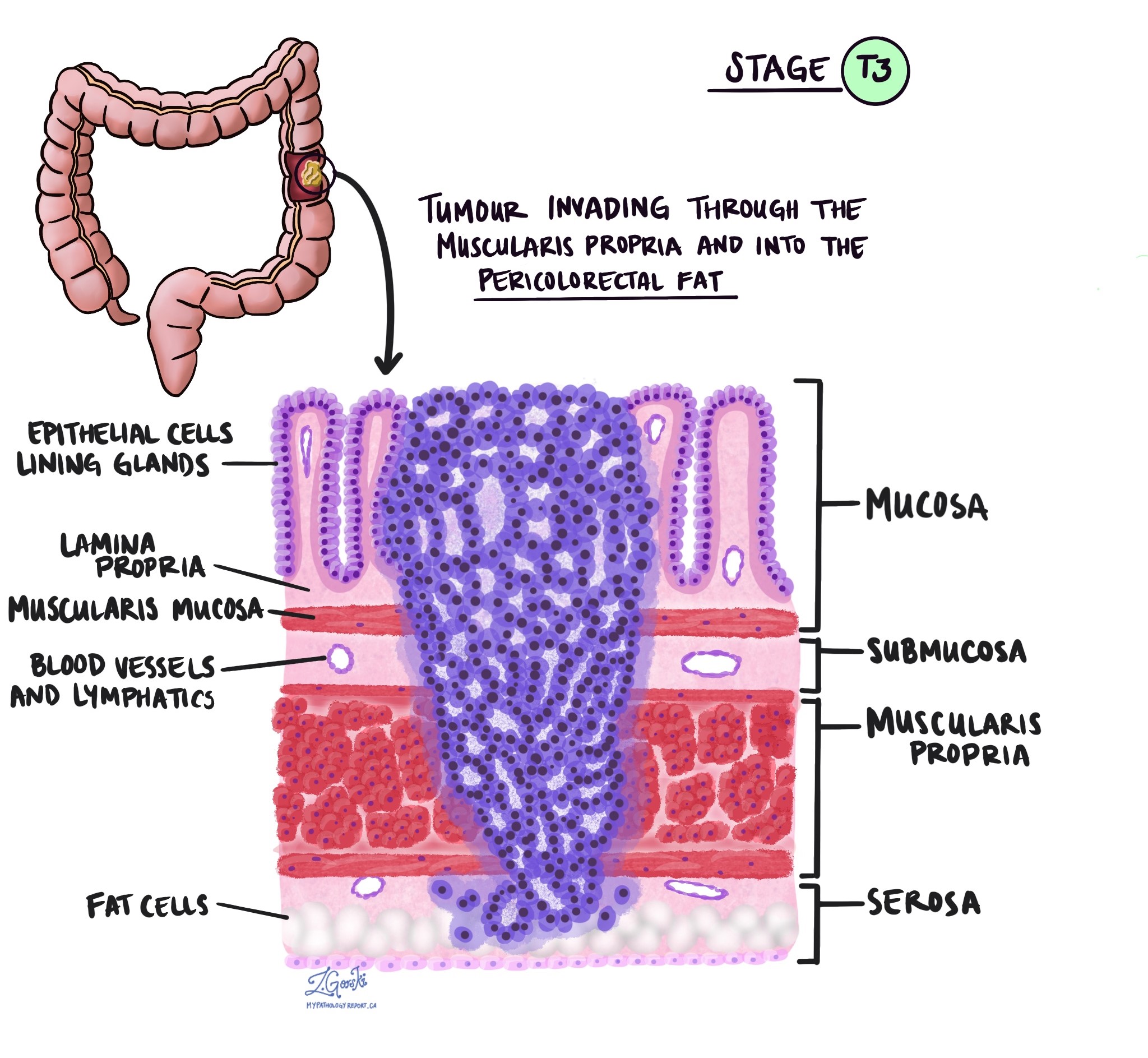
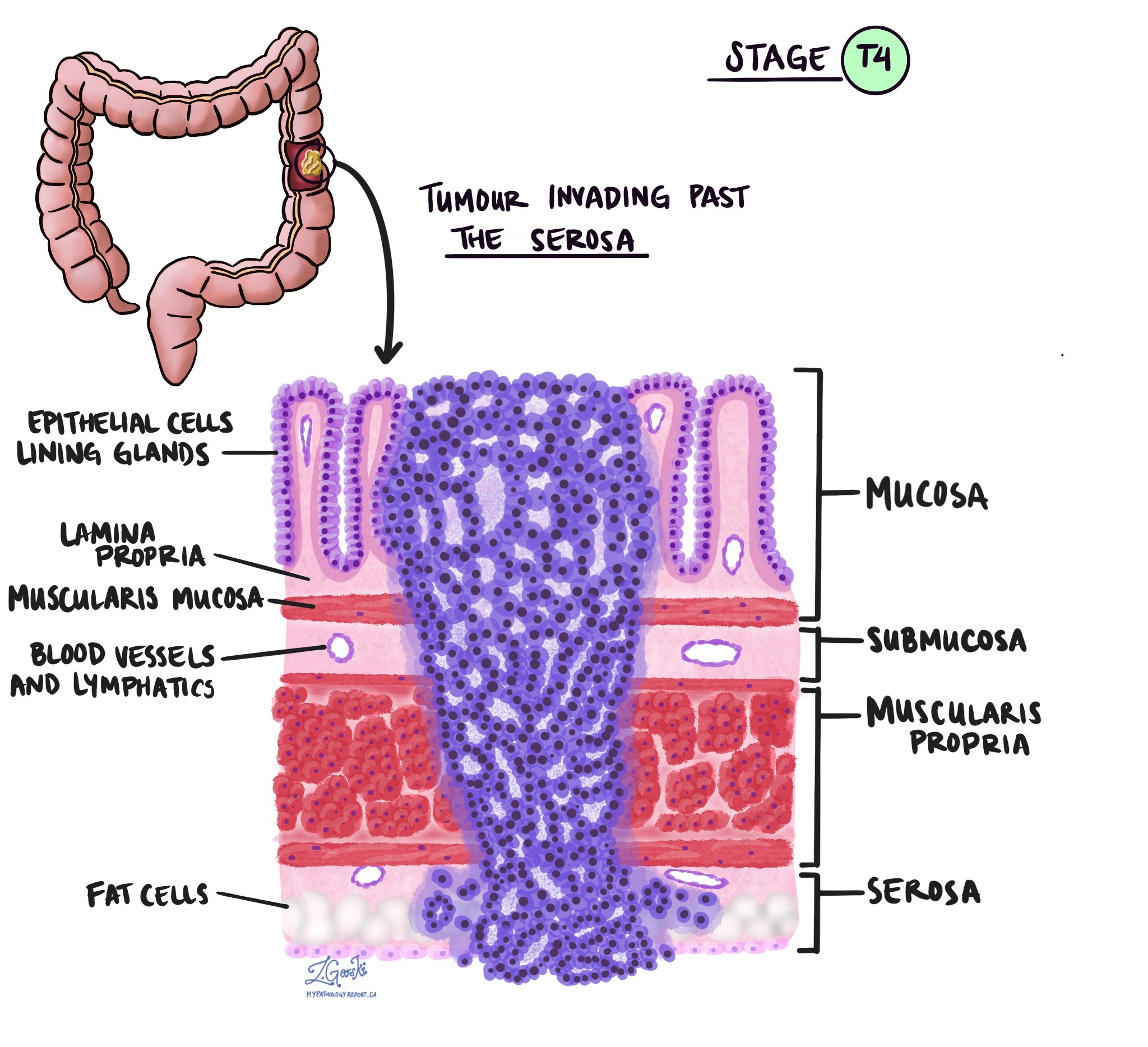
Invasiooni sügavus ja patoloogilise kasvaja staadium (pT)
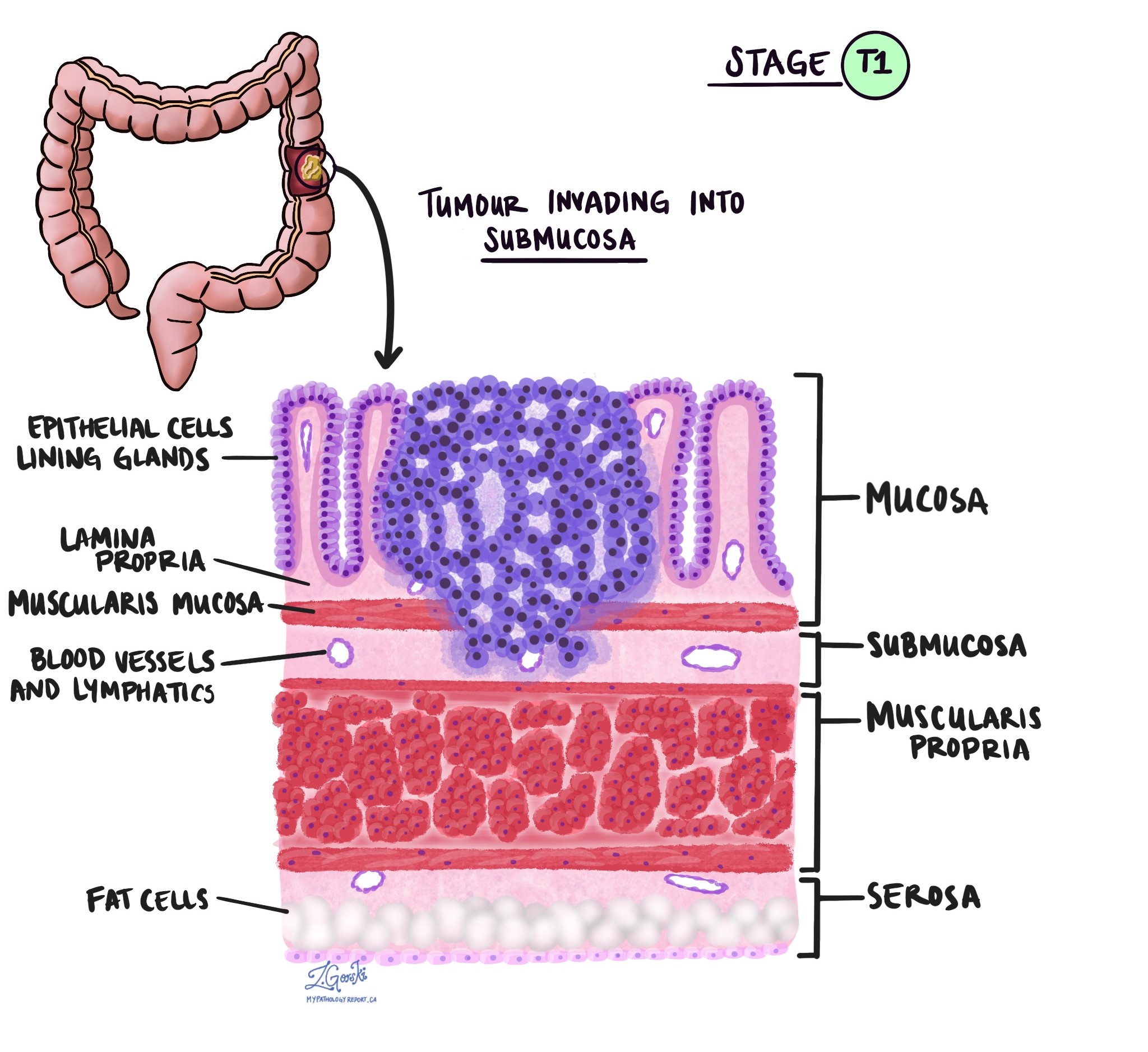
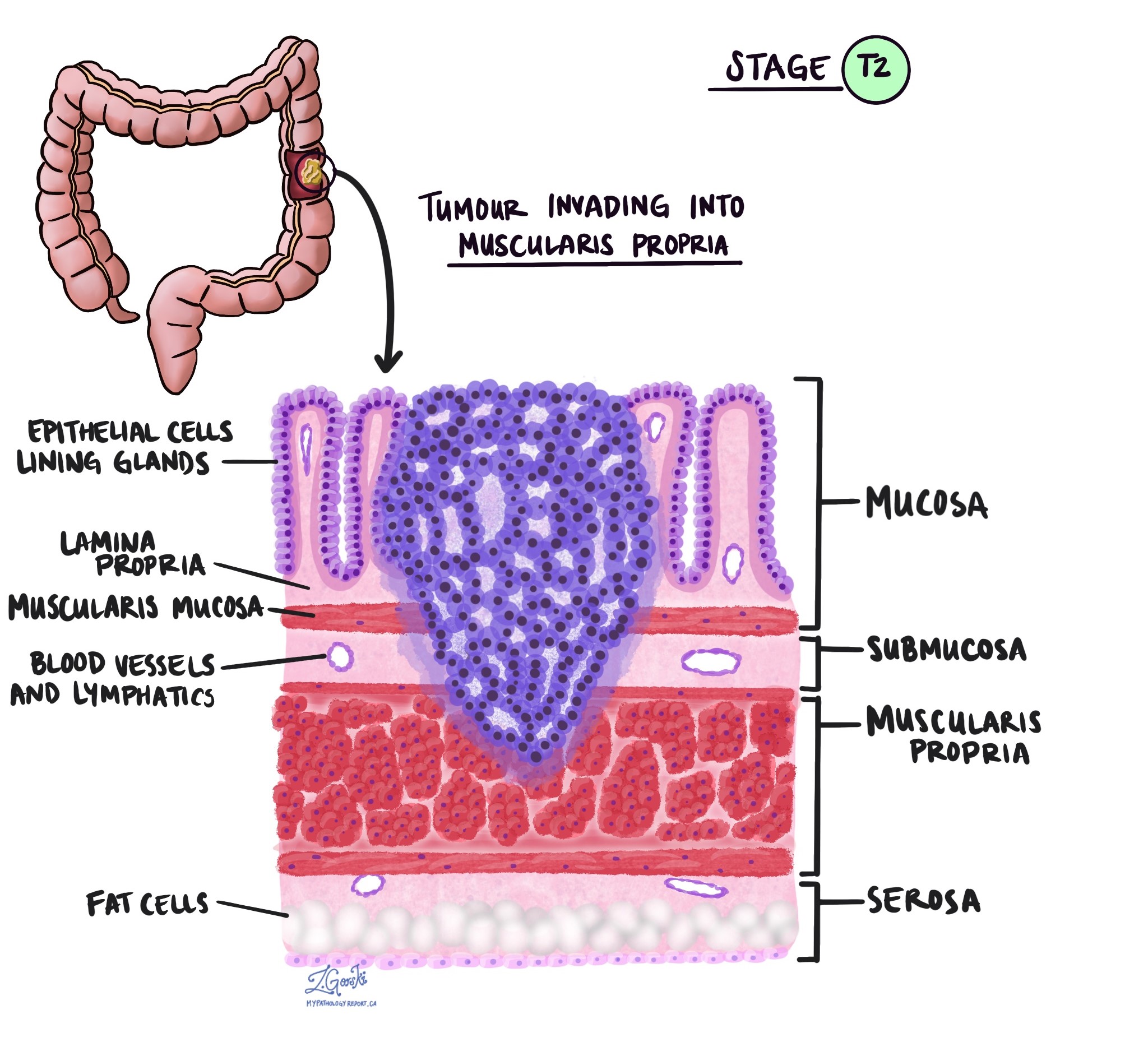
Patoloogias termin invasioon kirjeldab vähirakkude levikut kasvaja alguse kohta ümbritsevatesse organitesse või kudedesse. Kuna käärsoole invasiivne adenokartsinoom saab alguse käärsoole sisepinna õhukesest koekihist, mida nimetatakse limaskest, invasioon on määratletud kui vähirakkude levik käärsoole teistesse koekihtidesse või muudesse jämesoolest väljapoole jäävatesse organitesse. Invasiooni saab näha alles pärast seda, kui patoloog on kasvajat mikroskoobiga uurinud.
Kasvajat mikroskoobi all uurides näeb teie patoloog, kui kaugele on vähirakud limaskestalt ümbritsevasse koesse levinud. Seda nimetatakse invasiooni sügavuseks või tasemeks. Invasiooni sügavus on oluline, sest sügavamale käärsoole seina tungivad kasvajad levivad tõenäolisemalt teistesse kehaosadesse, nt. lümfisõlmed, maks või kopsud. Invasiooni taset kasutatakse ka patoloogilise kasvaja staadiumi (pT) määramiseks. Allolevad pildid näitavad seost invasiooni sügavuse ja patoloogilise kasvaja staadiumi vahel.
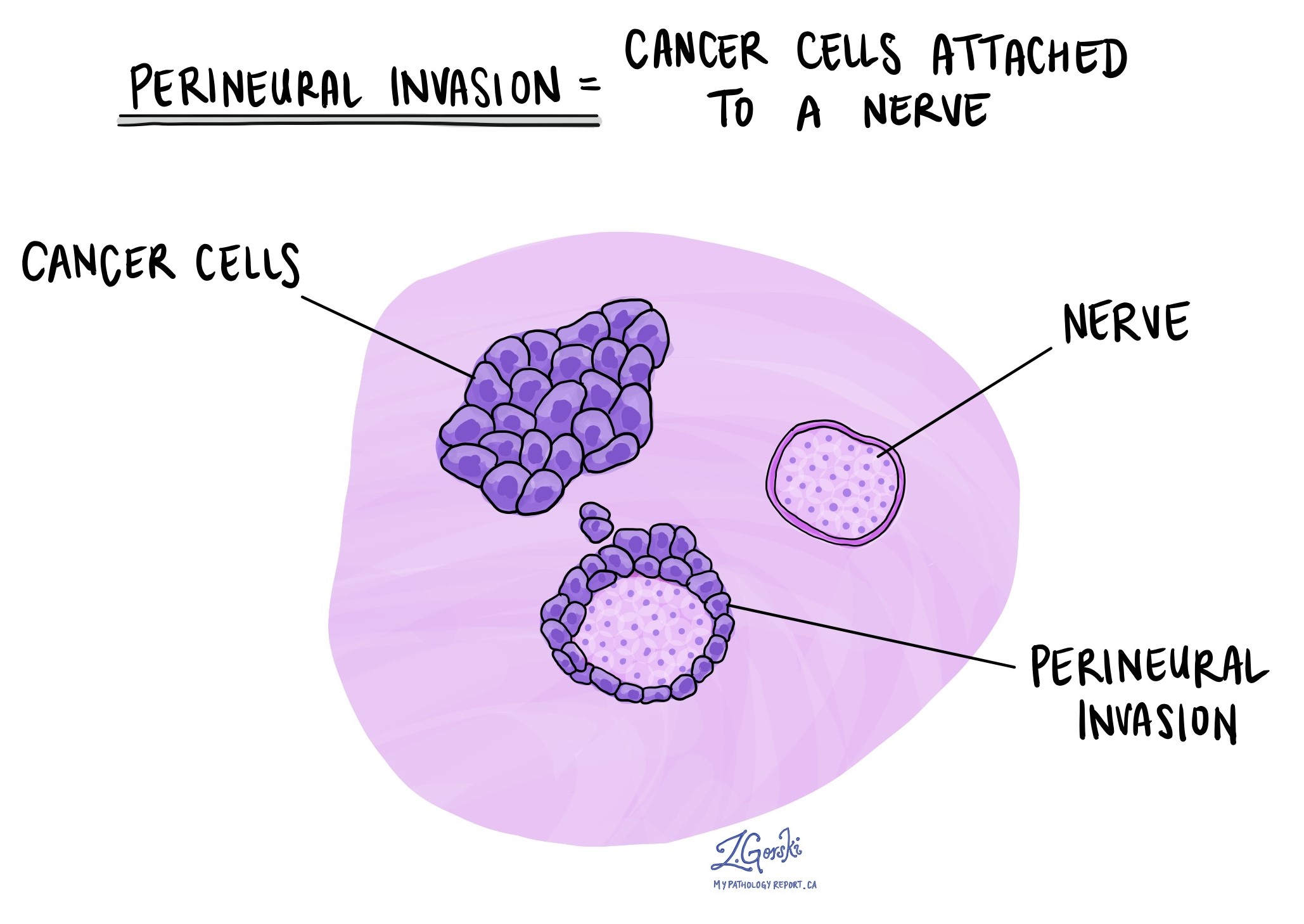
Perineuraalne invasioon
Patoloogid kasutavad terminit "perineuraalne invasioon", et kirjeldada olukorda, kus vähirakud kinnituvad närvi või tungivad närvi. "Intraneuraalne invasioon" on seotud termin, mis viitab konkreetselt närvi sees leiduvatele vähirakkudele. Närvid, mis meenutavad pikki juhtmeid, koosnevad rakkude rühmadest, mida nimetatakse neuroniteks. Need kogu kehas esinevad närvid edastavad keha ja aju vahel sellist teavet nagu temperatuur, rõhk ja valu. Perineuraalse invasiooni esinemine on oluline, kuna see võimaldab vähirakkudel liikuda mööda närvi lähedalasuvatesse organitesse ja kudedesse, suurendades pärast operatsiooni kasvaja kordumise ohtu.
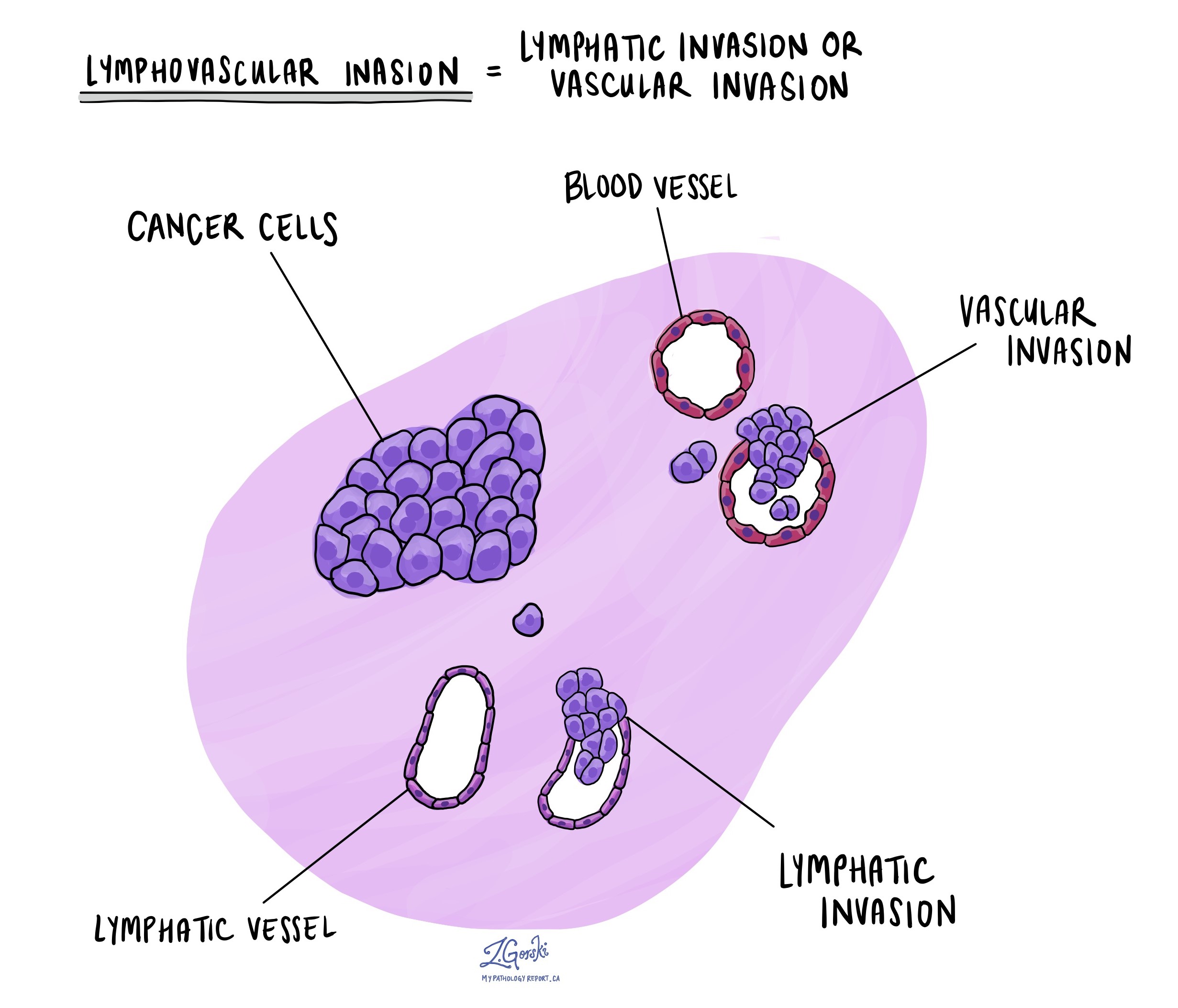
Lümfovaskulaarne invasioon
Lümfovaskulaarne invasioon tekib siis, kui vähirakud tungivad veresoontesse või lümfisoonesse. Veresooned on õhukesed torud, mis kannavad verd kogu kehas, samas kui lümfisooned kannavad vere asemel vedelikku, mida nimetatakse lümfiks. Need lümfisooned ühenduvad väikeste immuunorganitega, mis on hajutatud kogu kehas, tuntud kui lümfisõlmed.
Lümfovaskulaarne invasioon on oluline, kuna see võimaldab vähirakkudel levida vere või lümfisoonte kaudu teistesse kehaosadesse, sealhulgas lümfisõlmedesse või maksa. Lisaks on vähirakkude olemasolu suures veenis, mis asub käärsoole seinast väljaspool (väljaspool paksu lihaskimpu), seotud suure riskiga, et vähirakud leitakse lõpuks maksas.
Marginaalid
Patoloogias on marginaal kasvajaoperatsiooni käigus eemaldatud koe serv. Patoloogiaaruandes olev marginaal on oluline, kuna see näitab, kas kogu kasvaja eemaldati või mõni tuumor jäi maha. See teave aitab kindlaks teha edasise ravi vajaduse.
Patoloogid hindavad tavaliselt marginaale pärast sellist kirurgilist protseduuri nagu ekstsisioon or resektsioon, mille eesmärk on eemaldada kogu kasvaja. Marginaali ei hinnata tavaliselt pärast a biopsia, mis eemaldab ainult osa kasvajast. Esitatud servade arv ja nende suurus – kui palju normaalset kude on kasvaja ja lõikeserva vahel – varieerub sõltuvalt koe tüübist ja kasvaja asukohast.
Patoloogid uurivad piire, et kontrollida, kas koe lõikeservas on kasvajarakke. Positiivne marginaal, kus kasvajarakud leitakse, viitab sellele, et osa vähktõbe võib kehasse jääda. Seevastu negatiivne marginaal, mille servas ei ole kasvajarakke, viitab kasvaja täielikule eemaldamisele. Mõned aruanded mõõdavad ka kaugust lähimate kasvajarakkude ja veerise vahel, isegi kui kõik veerised on negatiivsed.

Kasvaja tekkimine
Kasvaja tekkimine on termin, mida patoloogid kasutavad kas üksikute vähirakkude või kasvaja servades nähtavate väikeste vähirakkude rühmade kirjeldamiseks. Arvatakse, et see on märk sellest, et kasvaja on vähem diferentseerunud. Mikroskoobi all nähtud pungade arvu põhjal määratakse skoor, kas madal, keskmine või kõrge. Kõrge skoor on seotud suurenenud riskiga, et vähirakud levivad teise kehaosasse.
Ravi mõju
Kui saite vähiravi (kas keemiaravi või kiiritusravi või mõlemat) enne kasvaja eemaldamist, uurib teie patoloog hoolikalt koe piirkonda, kus kasvaja varem tuvastati, et näha, kas vähirakud on veel elus (elujõulised). Kõige sagedamini kasutatav süsteem kirjeldab raviefekti skaalal 0 kuni 3, kus 0 tähendab, et elujõulised vähirakud ei ole (kõik vähirakud on surnud) ja 3 on ulatuslik jääkvähk ilma kasvaja ilmse regressioonita (kõik või suurem osa vähirakkudest). vähirakud on elus).
Kasvaja ladestumine
Kasvaja ladestus on vähirakkude rühm, mis on põhikasvajast eraldi, kuid mitte a lümfisõlm. Kasvaja ladestused on seotud suurema riskiga, et kasvajarakud levivad pärast ravi mõnda teise kehaossa, näiteks maksa või kopsudesse. Kasvaja ladestused määravad ka patoloogilise kasvaja staadiumi (pT).
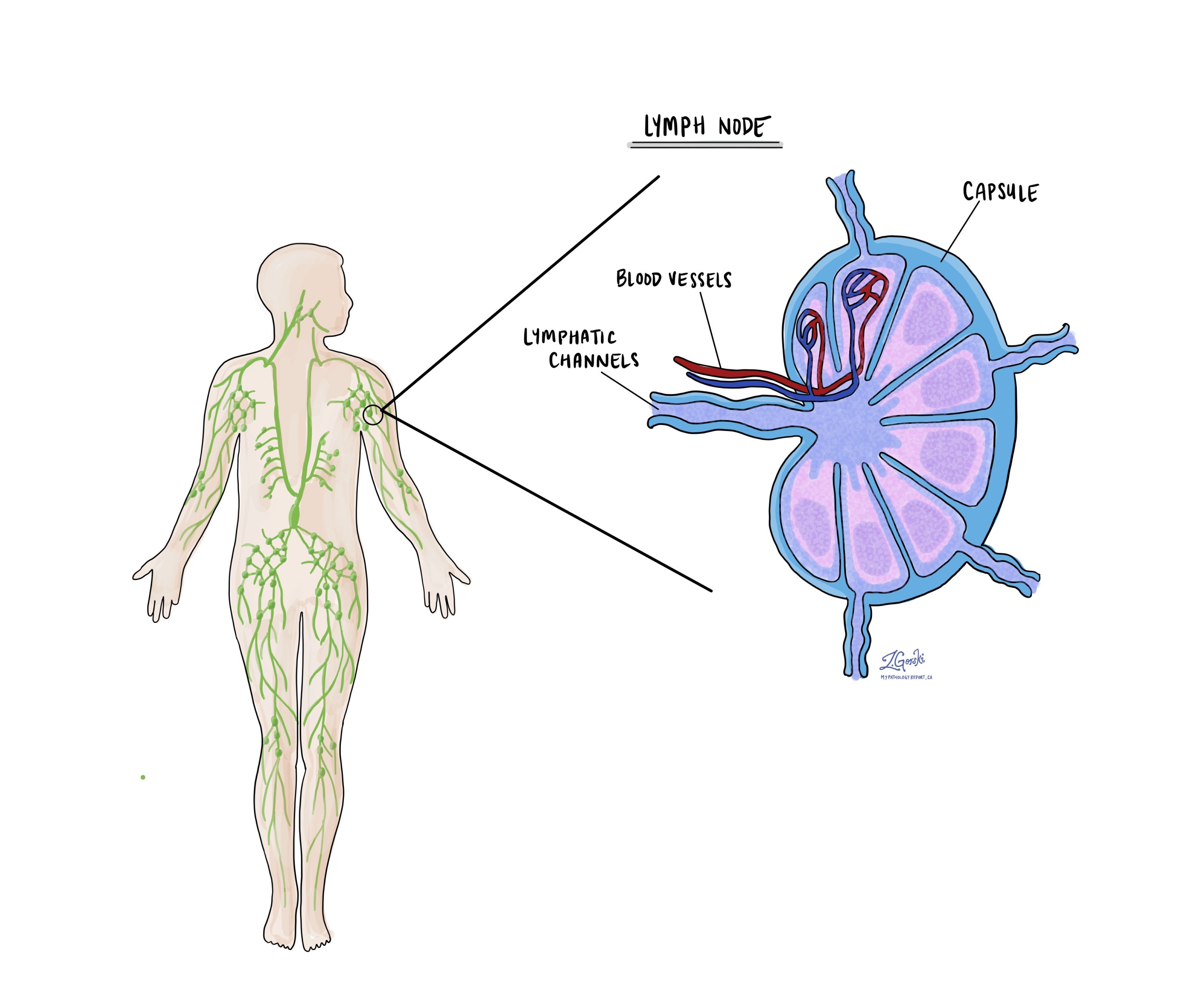
Lümfisõlmed
Väikesed immuunorganid, tuntud kui lümfisõlmed, paiknevad kogu kehas. Vähirakud võivad liikuda kasvajast nendesse lümfisõlmedesse väikeste lümfisoonte kaudu. Sel põhjusel eemaldavad arstid sageli lümfisõlmed ja uurivad neid mikroskoopiliselt vähirakkude otsimiseks. Seda protsessi, kus vähirakud liiguvad algsest kasvajast teise kehaosasse nagu lümfisõlme, nimetatakse metastaasid.
Vähirakud migreeruvad tavaliselt kõigepealt kasvaja lähedal asuvatesse lümfisõlmedesse, kuigi kahjustatud võivad olla ka kauged lümfisõlmed. Järelikult eemaldavad kirurgid tavaliselt kõigepealt kasvajale kõige lähemal asuvad lümfisõlmed. Nad võivad eemaldada kasvajast kaugemal asuvad lümfisõlmed, kui need on laienenud ja kui on tugev kahtlus, et need sisaldavad vähirakke.
Patoloogid uurivad kõik eemaldatud lümfisõlmed mikroskoobi all ja leiud kirjeldatakse üksikasjalikult teie aruandes. "Positiivne" tulemus näitab vähirakkude olemasolu lümfisõlmes, "negatiivne" aga tähendab, et vähirakke ei leitud. Kui aruanne leiab lümfisõlmest vähirakke, võib see määrata ka nende rakkude suurima klastri suuruse, mida sageli nimetatakse "fookuseks" või "hoiuseks". Ekstranodaalne pikendamine tekib siis, kui kasvajarakud tungivad läbi lümfisõlme väliskapsli ja levivad külgnevasse koesse.
Lümfisõlmede uurimine on oluline kahel põhjusel. Esiteks aitab see määrata patoloogilise sõlme staadiumi (pN). Teiseks viitab vähirakkude avastamine lümfisõlmedes suurenenud riskile leida hiljem vähirakke teistest kehaosadest. See teave aitab teie arstil otsustada, kas vajate täiendavat ravi, näiteks keemiaravi, kiiritusravi või immunoteraapiat.
Sobimatust parandavad valgud
Mismatch Repair (MMR) on süsteem kõigis normaalsetes tervetes rakkudes, mis parandab vead meie geneetilises materjalis (DNA). Süsteem koosneb erinevatest valkudest ja neli levinumat on MSH2, MSH6, MLH1 ja PMS2.
Neli mittevastavust parandavat valku MSH2, MSH6, MLH1 ja PMS2 töötavad kahjustatud DNA fikseerimiseks paarikaupa. Täpsemalt töötab MSH2 koos MSH6-ga ja MLH1 töötab koos PMS2-ga. Kui üks valk kaob, ei saa paar normaalselt funktsioneerida ja suureneb risk haigestuda vähki.
Kuidas patoloogid testivad mittevastavust parandavaid valke?
Kõige tavalisem viis mittevastavust parandavate valkude testimiseks on immunohistokeemia. See test võimaldab patoloogidel näha, kas kasvajarakud toodavad kõiki nelja mittevastavust parandavat valku. Selle testi tulemused esitatakse tavaliselt järgmiselt:
- Tavaline tulemus: säilinud valgu ekspressioon.
- Ebanormaalne tulemus: valgu ekspressiooni kadu.
Miks on ebakõla parandavate valkude testimine oluline?
Mittevastavuse parandamise testimine on oluline, kuna see võib aidata ennustada, kui hästi teatud ravimeetodid võivad toimida. Näiteks reageerivad ebakõla parandava valgu ekspressiooni kadumisega vähid tõenäolisemalt immunoteraapiale nagu PD-1 või PD-L1 inhibiitorid. Selle põhjuseks on asjaolu, et puudulikes kasvajates sageli leitud mutatsioonide suur arv võib toota uusi antigeene, mis muudavad kasvaja nähtavamaks ja immuunsüsteemi suhtes haavatavamaks.
Mittesobivuse parandamise testimine viiakse läbi ka patsientide tuvastamiseks, kellel võib olla Lynchi sündroom, tuntud ka kui pärilik mittepolüpoosne kolorektaalne vähk (HNPCC). Lynchi sündroom on geneetiline haigus, mis suurendab riski haigestuda erinevat tüüpi vähki, sealhulgas söögitoruvähki, käärsoolevähki, endomeetriumi vähki, munasarjavähki ja maovähki.
Muud käärsoole ja pärasoole invasiivse adenokartsinoomi geneetilised muutused
- APC (Adenomatous Polyposis Coli) geenimutatsioonid: sporaadiliste käärsoolevähi juhtumite korral peaaegu üldlevinud, on APC geeni mutatsioonid sageli kolorektaalse vähi arengu varajaseks sündmuseks. APC geen on kasvaja supressorgeen ja selle inaktiveerimine põhjustab rakkude ebanormaalset kasvu.
- KRAS- ja NRAS-mutatsioonid: RAS-i geeniperekonda kuuluvate KRAS- ja NRAS-geenide mutatsioonid esinevad ligikaudu 40–45% kolorektaalse vähi korral. Need mutatsioonid põhjustavad rakkude kontrollimatut jagunemist ja kasvu. Eelkõige on KRAS-i mutatsioonide esinemine seotud resistentsusega teatud anti-EGFR-i (epidermaalse kasvufaktori retseptori) ravi suhtes.
- BRAF-i mutatsioonid: BRAF-i geenimutatsiooni, eriti V600E-d, leidub umbes 10% kolorektaalvähi puhul. Seda seostatakse sageli halva prognoosi ja resistentsusega teatud ravimeetodite suhtes. BRAF-i mutatsioonid on sagedasemad vähkkasvajate puhul, mis on arenenud sakilise raja kaudu.
- PIK3CA mutatsioonid: mutatsioonid PIK3CA geenis, mis kodeerib fosfatidüülinositool-3-kinaasi (PI3K) subühikut, esinevad ligikaudu 10–20% kolorektaalvähi juhtudest. Need mutatsioonid võivad aktiveerida AKT signaaliraja, soodustades rakkude proliferatsiooni ja ellujäämist.
Testid, mida kasutatakse geneetiliste muutuste tuvastamiseks
- Järgmise põlvkonna sekveneerimine (NGS): NGS võimaldab mutatsioonide, deletsioonide ja amplifikatsioonide tuvastamiseks samaaegselt uurida mitut geeni. See kõikehõlmav lähenemisviis võimaldab hinnata kõiki tavalisi kolorektaalse vähi geneetilisi muutusi, sealhulgas APC, KRAS, NRAS, BRAF ja PIK3CA mutatsioone.
- Polümeraasi ahelreaktsioon (PCR): see meetod võimendab DNA segmente, võimaldades analüüsida spetsiifilisi geneetilisi muutusi, nagu KRAS-, NRAS- ja BRAF-mutatsioonid.
- Fluorestsents in situ hübridisatsioon (FISH): FISH suudab tuvastada geneetilisi kõrvalekaldeid, nagu amplifikatsioonid või deletsioonid konkreetsetes geenides. Seda kasutatakse harvemini mainitud geneetiliste muutuste rutiinseks tuvastamiseks, kuid see võib olla abiks konkreetsetes kontekstides.
Selle artikli kohta
Arstid kirjutasid selle artikli, et aidata teil lugeda ja mõista oma patoloogiaaruannet. Kontakt kui teil on selle artikli või oma patoloogiaaruande kohta küsimusi. Patoloogia aruande täieliku sissejuhatuse saamiseks lugege Käesoleva artikli.