door Bibianna Purgina, MD FRCPC
4 april 2024
Gededifferentieerd liposarcoom is een agressieve vorm van kanker die meestal diep in het lichaam begint, zoals de buik. Het wordt "gededifferentieerd" genoemd omdat het voortkomt uit een vergelijkbare, maar minder agressieve vorm van kanker die wordt genoemd goed gedifferentieerd liposarcoom/atypische lipomateuze tumor. De term 'liposarcoom' betekent dat de kanker oorspronkelijk uit vet bestond, maar tijdens het proces van dedifferentiatie werden de meeste vetcellen vervangen door niet-vetbevattende kankercellen.
Wat veroorzaakt gededifferentieerd liposarcoom?
Bijna alle gededifferentieerde liposarcomen herbergen een genetische verandering waarbij de genen betrokken zijn MDM2 en CDK4. Op dit moment weten artsen niet wat de oorzaak is van deze genetische verandering.
Wat zijn de symptomen van gededifferentieerd liposarcoom?
De meeste gededifferentieerde liposarcomen presenteren zich als een grote, pijnloze massa. Degenen die zich op een diepe plaats bevinden, zoals de buik, kunnen onopgemerkt blijven totdat de tumor erg groot is.
Hoe wordt deze diagnose gesteld?
De eerste diagnose van gededifferentieerd liposarcoom wordt meestal gesteld nadat een klein stukje van de tumor is verwijderd in een procedure die a biopsie. Het biopsieweefsel wordt vervolgens naar een patholoog gestuurd die het onder een microscoop onderzoekt. De diagnose kan ook worden gesteld nadat de gehele tumor is verwijderd als een uitsnijding or resectie exemplaar.
Microscopische kenmerken van deze tumor
Bij microscopisch onderzoek onthult gededifferentieerd liposarcoom twee verschillende componenten. De eerste bestaat uit vetproducerende tumorcellen, die sterk lijken op die gevonden in lagere kwaliteit, goed gedifferentieerd liposarcoom. De tweede component bestaat uit niet-vetproducerende tumorcellen, die er vaak zeer abnormaal uitzien en verschillende andere sarcomen kunnen nabootsen, zoals ongedifferentieerd pleomorf sarcoom, myxofibrosarcoom en osteosarcoom. De aanwezigheid van goed gedifferentieerd liposarcoom naast een niet-vetproducerend sarcoom stelt pathologen in staat gededifferentieerd liposarcoom te diagnosticeren.

Waar u op moet letten in uw pathologierapport voor gededifferentieerd liposarcoom:
Rang van de Franse Federatie van Kankercentra Sarcoma Group (FNCLCC).
Pathologen verdelen gededifferentieerd liposarcoom in drie graden op basis van een systeem dat is ontwikkeld door de Franse Federatie van Kankercentra Sarcoma Group (FNCLCC). Dit systeem gebruikt drie microscopische kenmerken om de tumorgraad te bepalen: differentiatie, mitotische telling en necrose. Deze functies worden hieronder in meer detail uitgelegd. De graad kan pas worden bepaald nadat een stukje van de tumor onder de microscoop is onderzocht.
Punten (van 0 tot 3) worden toegekend voor elk van de microscopische kenmerken (0 tot 3) en het totale aantal punten bepaalt de uiteindelijke graad van de tumor. Volgens dit systeem kan ongedifferentieerd liposarcoom laag- of hooggradige tumoren zijn. De tumorgraad is belangrijk omdat hooggradige tumoren (graad 2 en 3) agressiever zijn en gepaard gaan met een slechtere prognose.
Punten gekoppeld aan elk cijfer:
- Grade 1 – 2 of 3 punten.
- Grade 2 – 4 of 5 punten.
- Grade 3 – 6 tot 8 punten.
Microscopische kenmerken die worden gebruikt om de kwaliteit te bepalen:
- Tumordifferentiatie - Tumor differentiatie beschrijft hoe goed de tumorcellen lijken op normale vetcellen. Tumoren die erg lijken op normale vetcellen krijgen 1 punt, terwijl tumoren die er heel anders uitzien dan normale vetcellen 2 of 3 punten krijgen. Alle gededifferentieerde liposarcomen krijgen 3 punten voor tumordifferentiatie.
- Mitotische telling - Een cel die zich aan het delen is om twee nieuwe cellen te maken, wordt a . genoemd mitotische figuur. Tumoren die snel groeien, hebben over het algemeen meer mitotische figuren dan tumoren die langzaam groeien. Uw patholoog bepaalt het mitotische aantal door het aantal mitotische figuren in tien gebieden van de tumor te tellen terwijl u door de microscoop kijkt. Tumoren zonder mitotische figuren of heel weinig mitotische figuren krijgen 1 punt, terwijl tumoren met 10 tot 20 mitotische figuren 2 punten krijgen en tumoren met meer dan 20 mitotische figuren 3 punten.
- Necrose - Necrose is een vorm van celdood. Tumoren die snel groeien hebben meer necrose dan tumoren die langzaam groeien. Als uw patholoog geen necrose ziet, krijgt de tumor 0 punten. De tumor krijgt 1 punt als necrose wordt gezien maar minder dan 50% van de tumor uitmaakt, of 2 punten als necrose meer dan 50% van de tumor uitmaakt.
MDM2
MDM2 is een gen dat celdeling (het aanmaken van nieuwe cellen) bevordert. Normale cellen en die in niet-kankerachtige tumoren hebben twee kopieën van het MDM2-gen. Beide daarentegen goed gedifferentieerd liposarcoom en gededifferentieerd liposarcoom hebben meer dan twee kopieën van het MDM2-gen.
Een test genaamd fluorescentie in situ hybridisatie (FISH) wordt vaak gebruikt om het aantal MDM2-genen in een cel te tellen. Een groter aantal genen (meer dan twee) wordt amplificatie genoemd en ondersteunt de diagnose van gededifferentieerd liposarcoom.
Tumorgrootte
Tumorgrootte is belangrijk omdat tumoren kleiner dan 5 cm minder snel uitzaaien naar andere delen van het lichaam en geassocieerd zijn met een betere prognose. Tumorgrootte wordt ook gebruikt om het pathologische tumorstadium (pT) te bepalen.
Tumor extensie
Gededifferentieerd liposarcoom begint in vet, maar de tumor kan in of rond andere weefsels en organen groeien. Dit wordt tumorextensie genoemd. Uw patholoog zal alle omliggende weefsels of organen die zijn ingeleverd op tumorcellen zorgvuldig onderzoeken en het resultaat van dit onderzoek zal in uw rapport worden beschreven.
Behandelingseffect
Als u een behandeling (chemotherapie, bestraling of beide) voor uw kanker heeft gekregen voordat de tumor is verwijderd, zal uw patholoog het gebied van het weefsel waar de tumor eerder werd geïdentificeerd zorgvuldig onderzoeken om te zien of er nog kankercellen in leven zijn (levensvatbaar). ). Het meest gebruikte systeem beschrijft het behandeleffect op een schaal van 0 tot 3, waarbij 0 geen levensvatbare kankercellen betekent (alle kankercellen zijn dood) en 3 uitgebreide resterende kanker is zonder duidelijke regressie van de tumor (alle of de meeste van de kankercellen). kankercellen leven).
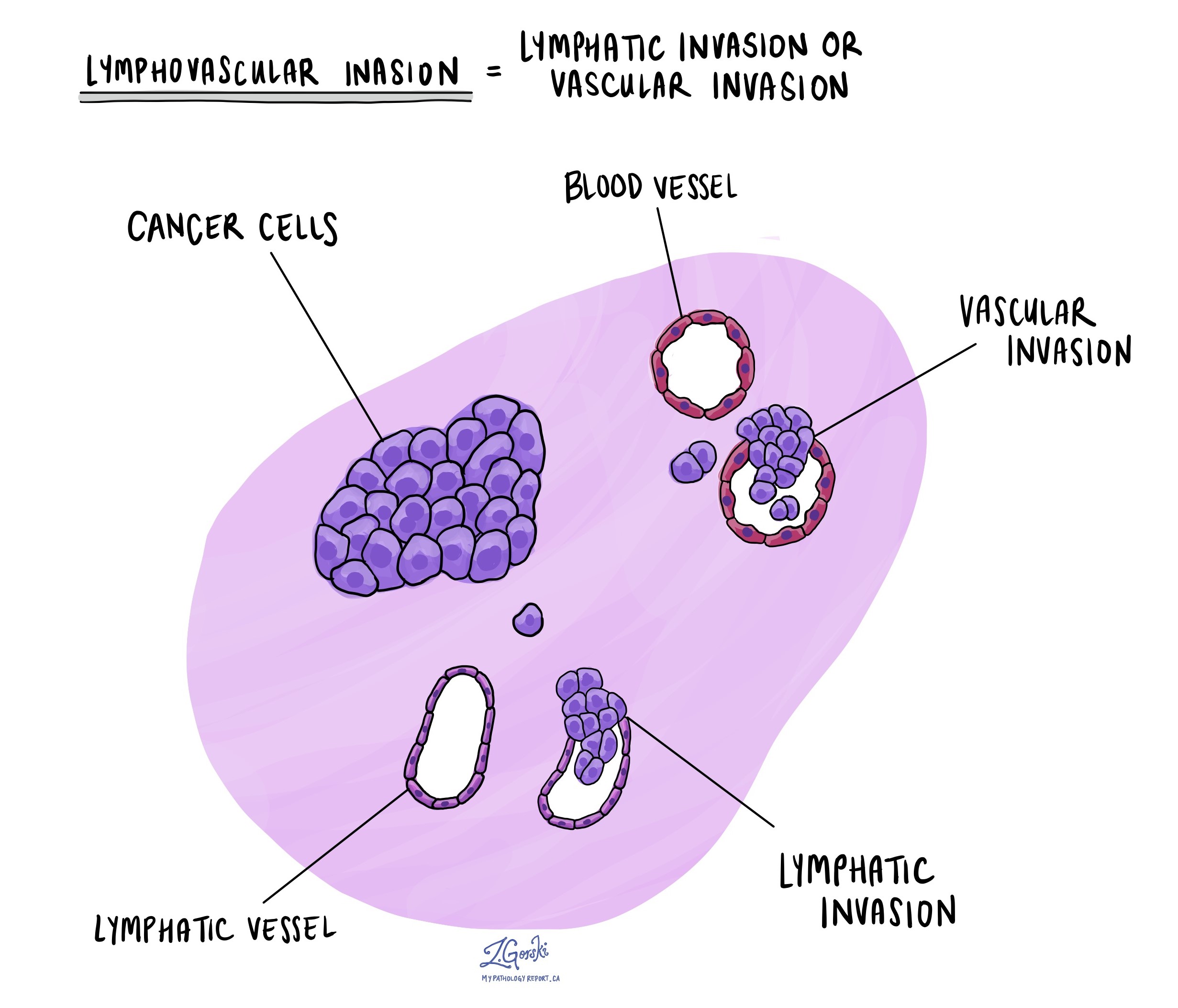
Lymfovasculaire invasie
Lymfovasculaire invasie vindt plaats wanneer kankercellen een bloedvat of lymfevaten binnendringen. Bloedvaten, dunne buisjes die bloed door het lichaam transporteren, staan in contrast met lymfevaten, die een vloeistof transporteren die lymfe wordt genoemd in plaats van bloed. Deze lymfevaten zijn verbonden met kleine immuunorganen die bekend staan als lymfeklieren, verspreid over het hele lichaam. Lymfovasculaire invasie is belangrijk omdat kankercellen zich hierdoor via het bloed of de lymfevaten kunnen verspreiden naar andere lichaamsdelen, waaronder de lymfeklieren of de lever.
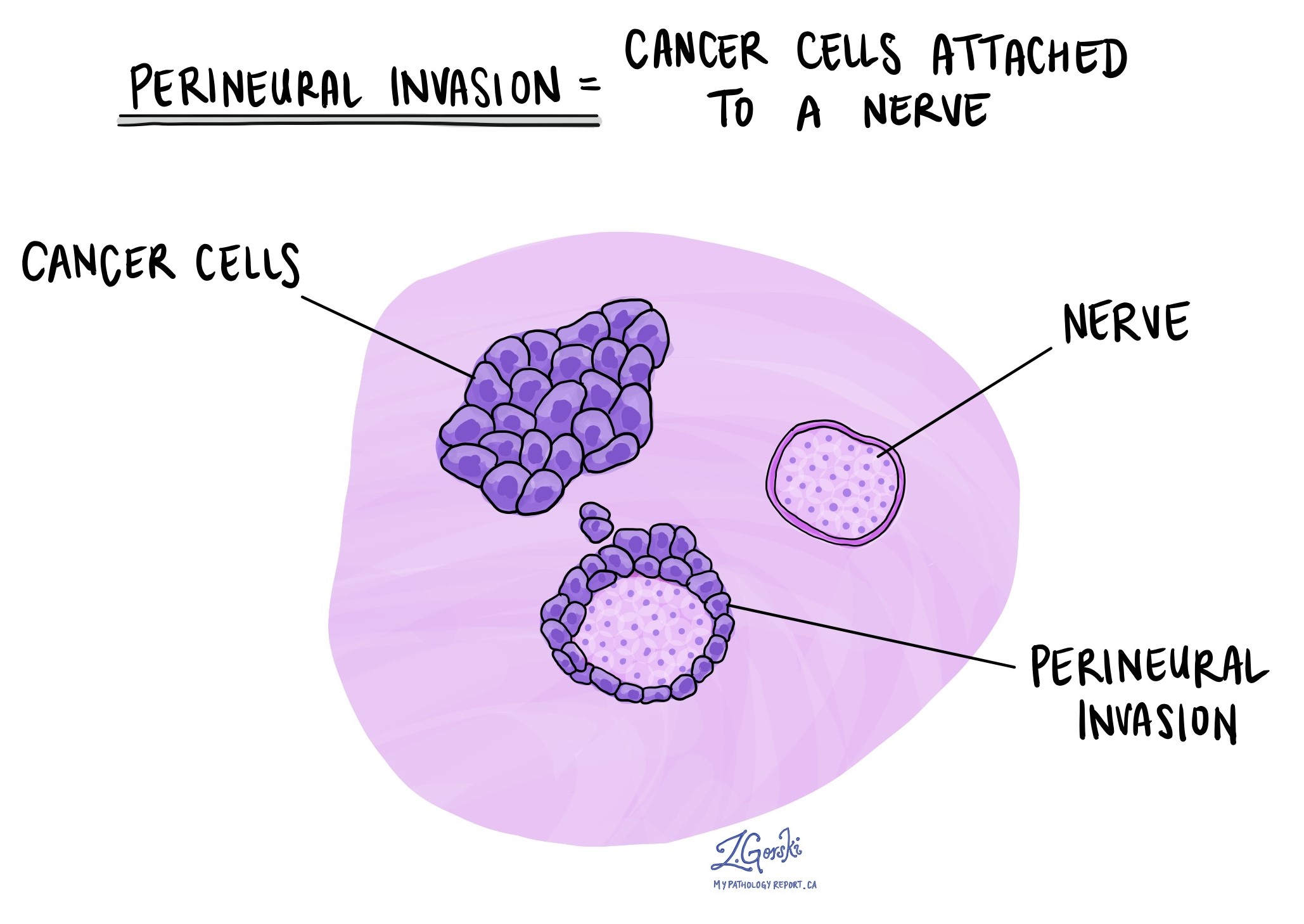
Perineurale invasie
Pathologen gebruiken de term ‘perineurale invasie’ om een situatie te beschrijven waarin kankercellen zich hechten aan een zenuw of deze binnendringen. ‘Intraneurale invasie’ is een verwante term die specifiek verwijst naar kankercellen die in een zenuw worden aangetroffen. Zenuwen, die op lange draden lijken, bestaan uit groepen cellen die bekend staan als neuronen. Deze zenuwen, die door het hele lichaam aanwezig zijn, verzenden informatie zoals temperatuur, druk en pijn tussen het lichaam en de hersenen. De aanwezigheid van perineurale invasie is belangrijk omdat kankercellen hierdoor langs de zenuw naar nabijgelegen organen en weefsels kunnen reizen, waardoor het risico toeneemt dat de tumor na de operatie terugkeert.
Marges
In de pathologie verwijst een marge naar de rand van het weefsel dat tijdens een tumoroperatie wordt verwijderd. De margestatus in een pathologierapport is belangrijk omdat deze aangeeft of de gehele tumor is verwijderd of dat er een deel is achtergebleven. Deze informatie helpt bij het bepalen van de noodzaak voor verdere behandeling.
Pathologen beoordelen doorgaans de marges na een chirurgische ingreep zoals een uitsnijding or resectie, gericht op het verwijderen van de gehele tumor. Marges worden meestal niet geëvalueerd na een biopsie, waarbij slechts een deel van de tumor wordt verwijderd. Het aantal gerapporteerde marges en hun grootte – hoeveel normaal weefsel zich tussen de tumor en de snijrand bevindt – variëren afhankelijk van het weefseltype en de tumorlocatie.
Pathologen onderzoeken de marges om te controleren of er tumorcellen aanwezig zijn aan de snijrand van het weefsel. Een positieve marge, waar tumorcellen worden gevonden, suggereert dat er mogelijk kanker in het lichaam achterblijft. Daarentegen suggereert een negatieve marge, zonder tumorcellen aan de rand, dat de tumor volledig was verwijderd. Sommige rapporten meten ook de afstand tussen de dichtstbijzijnde tumorcellen en de marge, zelfs als alle marges negatief zijn.

Pathologisch stadium (pTNM)
Het pathologische stadium voor gededifferentieerd liposarcoom is gebaseerd op het TNM-stadiëringssysteem, een internationaal erkend systeem gecreëerd door de Amerikaans Gemengd Comité voor Kanker. Dit systeem gebruikt informatie over de primaire tumor (T), lymfeklieren (N), en verre metastatische ziekte (M) om het volledige pathologische stadium (pTNM) te bepalen. Uw patholoog onderzoekt het ingeleverde weefsel en geeft elk onderdeel een nummer. Over het algemeen betekent een hoger aantal een meer gevorderde ziekte en een slechtere prognose.
Tumorstadium (pT)
Het tumorstadium voor gededifferentieerd liposarcoom varieert op basis van het betrokken lichaamsdeel. Zo krijgt een tumor van 5 centimeter die in het hoofd begint een ander tumorstadium dan een tumor die diep achter in de buik begint (het retroperitoneum). Op de meeste plaatsen op het lichaam omvat het tumorstadium echter de tumorgrootte en of de tumor is uitgegroeid tot omliggende lichaamsdelen.
Tumoren beginnend in het hoofd en de nek:
T1 – De tumor is niet groter dan 2 centimeter.
T2 – De tumor is tussen de 2 en 4 centimeter groot.
T3 – De tumor is groter dan 4 centimeter.
T4 – De tumor is uitgegroeid tot omliggende weefsels zoals de botten van het gezicht of de schedel, het oog, de grotere bloedvaten in de nek of de hersenen.
Tumoren die beginnen aan de buitenkant van de borst, rug of buik en de armen of benen (romp en ledematen):
T1 – De tumor is niet groter dan 5 centimeter.
T2 – De tumor is tussen de 5 en 10 centimeter groot.
T3 – De tumor is tussen de 10 en 15 centimeter groot.
T4 – De tumor is groter dan 15 centimeter.
Tumoren die beginnen in de buik en organen in de borst (thoracale viscerale organen):
T1 – De tumor wordt slechts in één orgaan gezien.
T2 – De tumor is uitgegroeid tot het bindweefsel rondom het orgaan waar het vandaan kwam.
T3 – De tumor is uitgegroeid tot minstens één ander orgaan.
T4 – Er worden meerdere tumoren gevonden.
Tumoren die beginnen in de ruimte helemaal achterin de buikholte (retroperitoneum):
T1 – De tumor is niet groter dan 5 centimeter.
T2 – De tumor is tussen de 5 en 10 centimeter groot.
T3 – De tumor is tussen de 10 en 15 centimeter groot.
T4 – De tumor is groter dan 15 centimeter.
Tumoren die beginnen in de ruimte rond het oog (baan):
T1 – De tumor is niet groter dan 2 centimeter.
T2 – De tumor is groter dan 2 centimeter, maar is niet uitgegroeid tot de botten rond het oog.
T3 – De tumor is uitgegroeid tot de botten rond het oog of andere botten van de schedel.
T4 – De tumor is uitgegroeid tot het oog (de wereldbol) of de omliggende weefsels zoals de oogleden, sinussen of hersenen.
Nodale fase (pN)
Gededifferentieerd liposarcoom krijgt een knoopstadium tussen 0 en 1 op basis van de aanwezigheid of afwezigheid van kankercellen in een of meer lymfeklieren. Als er geen kankercellen worden gezien in lymfeklieren, is het nodale stadium N0. Als er geen lymfeklieren worden opgestuurd voor pathologisch onderzoek, kan het knoopstadium niet worden bepaald en wordt het knoopstadium vermeld als NX. Als kankercellen worden gevonden in lymfeklieren, wordt het knoopstadium vermeld als: N1.
Over dit artikel
Artsen hebben dit artikel geschreven om u te helpen uw pathologierapport te lezen en te begrijpen. Algemene inlichtingen als u vragen heeft over dit artikel of uw pathologierapport. Voor een volledige inleiding tot uw pathologierapport kunt u lezen dit artikel.


