par Jason Wasserman MD PhD FRCPC et Zuzanna Gorski MD
15 janvier 2024
L'adénocarcinome invasif (également appelé adénocarcinome du côlon) est le type de cancer du côlon le plus courant. Il est constitué de cellules qui recouvrent normalement la surface interne du côlon. Ce type de cancer commence souvent par un polype tel qu'un adénome tubulaire, adénome tubulovilleuxou adénome villeux.
Cet article vous aidera à comprendre votre diagnostic et votre rapport de pathologie pour l'adénocarcinome invasif du côlon.
Le côlon
Le côlon fait partie du système digestif et constitue la première partie du gros intestin. Il s’agit d’un long tube creux qui commence à l’extrémité de l’intestin grêle et se termine au rectum. Le côlon est divisé en quatre parties : ascendante (à droite), transversale, descendante (à gauche) et sigmoïde. Il joue un rôle crucial dans le traitement des déchets et dans l’absorption de l’eau, des électrolytes et de certaines vitamines. L'adénocarcinome invasif peut survenir dans n'importe quelle partie du côlon.
Quelles sont les causes de l’adénocarcinome invasif du côlon ?
On pense que l’adénocarcinome invasif du côlon est causé par une combinaison de facteurs environnementaux et génétiques. Les facteurs de risque établis comprennent une consommation excessive de viandes transformées, de viandes rouges et d’alcool. Les personnes ayant un excès de graisse corporelle courent également un risque accru de développer ce type de cancer. Prolongé inflammation dans le côlon, que l’on peut observer dans les maladies inflammatoires de l’intestin (colite ulcéreuse et maladie de Crohn), est également associée à un risque accru de développer un adénocarcinome invasif.
Quels sont les symptômes de l’adénocarcinome invasif du côlon ?
Les symptômes de l'adénocarcinome invasif dépendent de la localisation de la tumeur dans le côlon. Les tumeurs du côlon gauche (côlon descendant) ou du rectum peuvent provoquer des modifications des habitudes intestinales, des selles sanglantes, des douleurs abdominales ou des ballonnements. Les tumeurs du côlon droit (côlon ascendant) peuvent ne provoquer aucun symptôme jusqu’à ce que la tumeur soit très volumineuse ou qu’elle se soit propagée à d’autres parties du corps.
Où commence l’adénocarcinome invasif dans le côlon ?
L'adénocarcinome invasif du côlon est dû à cellules épithéliales se trouve normalement sur la surface interne du côlon. Ces cellules épithéliales se connectent pour former des structures appelées glandes. Les glandes, ainsi que la lamina propria et la musculeuse muqueuse sous-jacentes, forment une fine couche de tissu appelée muqueuse. Lorsque les cellules tumorales sont entièrement situées dans la muqueuse, on parle alors de dysplasie de haut grade.
La dysplasie de haut grade est considérée comme une affection précancéreuse non invasive et les cellules tumorales ne peuvent pas métastaser (propagation) à d’autres parties du corps. Cependant, à mesure que la tumeur se développe et que les cellules envahissent les couches de tissu sous-jacentes, le diagnostic évolue vers un adénocarcinome invasif. Contrairement à la dysplasie de haut grade, les cellules tumorales du carcinome invasif peuvent métastaser (se propager) à ganglions lymphatiques et d'autres parties du corps.

Caractéristiques microscopiques de cette tumeur
À l'examen microscopique, l'adénocarcinome invasif du côlon est constitué de groupes de cellules anormales. cellules épithéliales généralement disposés de taille invariable glandes (qui peuvent ressembler aux glandes normales du côlon), des nids ou des feuilles.
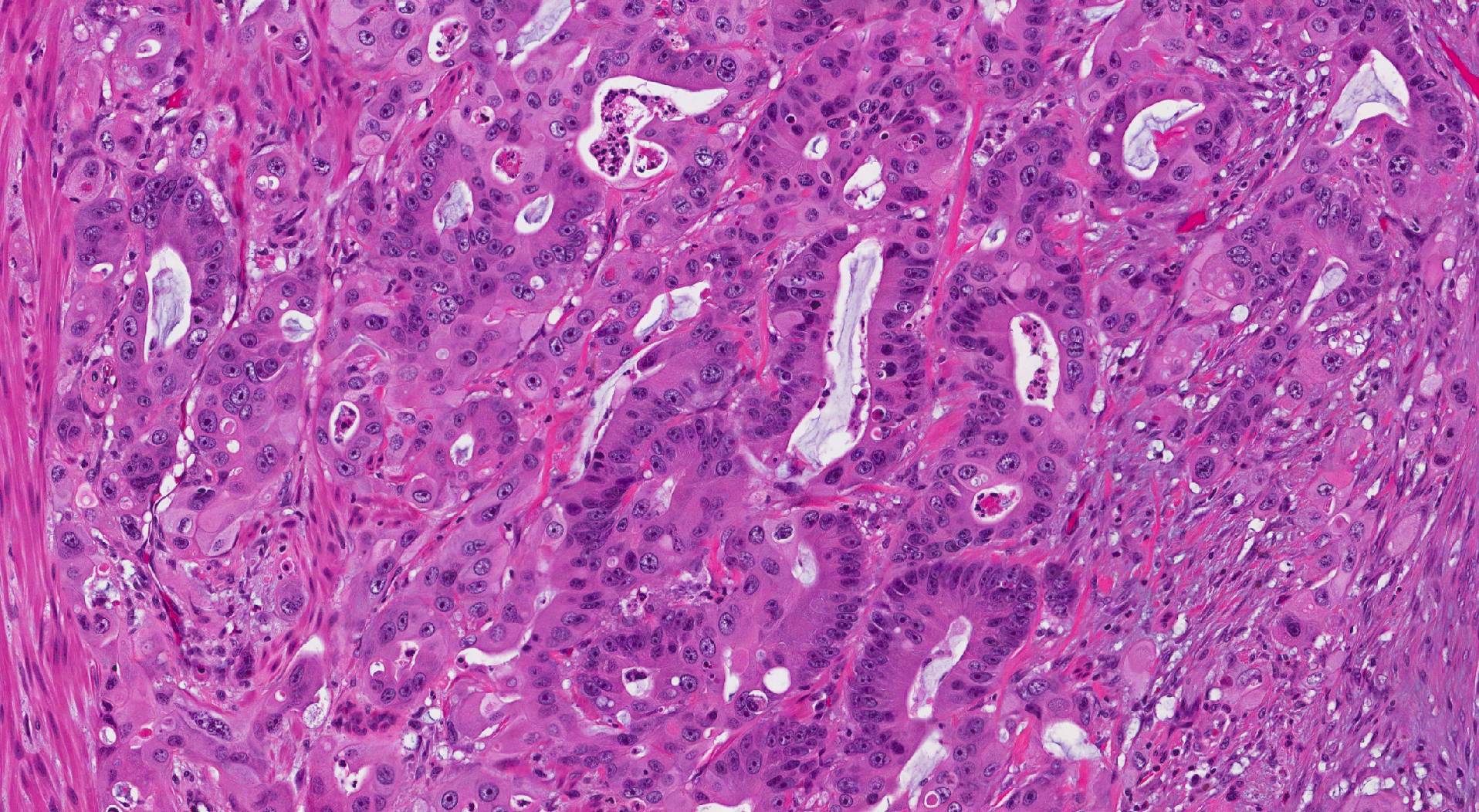
Que rechercher dans votre rapport de pathologie d'un adénocarcinome invasif du côlon :
Différenciation mucineuse
Les pathologistes utilisent le terme de différenciation mucineuse pour décrire les tumeurs qui contiennent une grande quantité de cellules extracellulaires. mucine. La mucine est un type spécialisé de protéine fabriquée à la fois par les cellules normales et les cellules tumorales. Extracellulaire signifie que la mucine a été observée à l'extérieur des cellules tumorales. Si plus de 50 % de la tumeur est constituée de mucine, la tumeur est appelée adénocarcinome mucineux.
Grade histologique
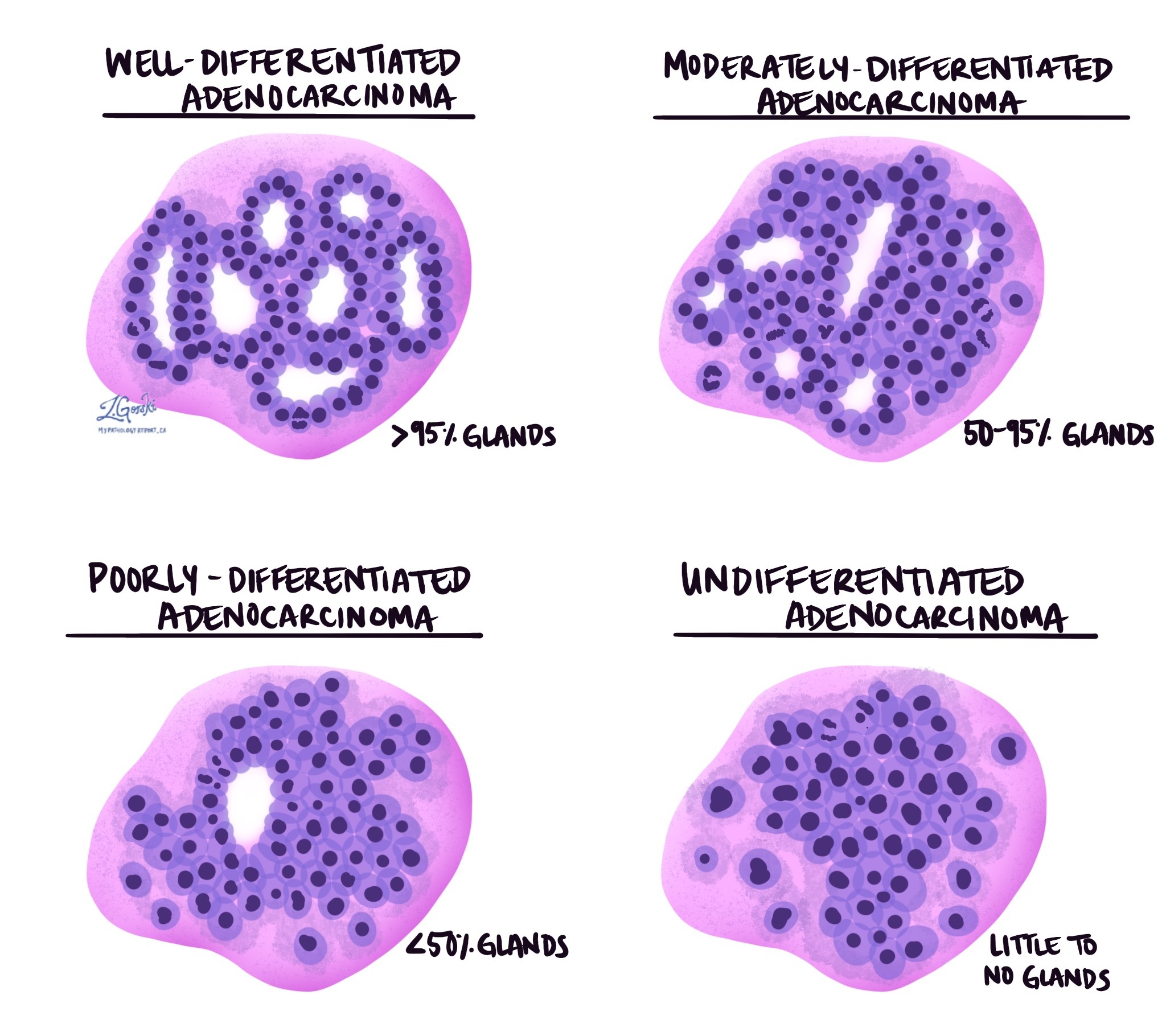
L'adénocarcinome invasif du côlon est divisé en trois grades : bien différencié, modérément différencié et peu différencié. Le grade est basé sur le pourcentage de cellules tumorales formant des structures rondes appelées glandes. Une tumeur qui ne forme aucune glande est dite indifférenciée. Le grade est important car les tumeurs peu différenciées et indifférenciées ont tendance à se comporter de manière plus agressive ; par exemple, ces tumeurs sont plus susceptibles de se propager ganglions lymphatiques et d'autres parties du corps.
- Bien différencié : Plus de 95 % de la tumeur est constituée de glandes. Les pathologistes décrivent également ces tumeurs comme étant de grade 1.
- Modérément différencié : 50 à 95 % de la tumeur est constituée de glandes. Les pathologistes décrivent également ces tumeurs comme étant de grade 2.
- Peu différenciée : moins de 50 % de la tumeur est constituée de glandes. Les pathologistes décrivent également ces tumeurs comme étant de grade 3.
- Indifférencié : très peu de glandes sont visibles dans la tumeur.
Profondeur d'invasion et stade pathologique de la tumeur (pT)
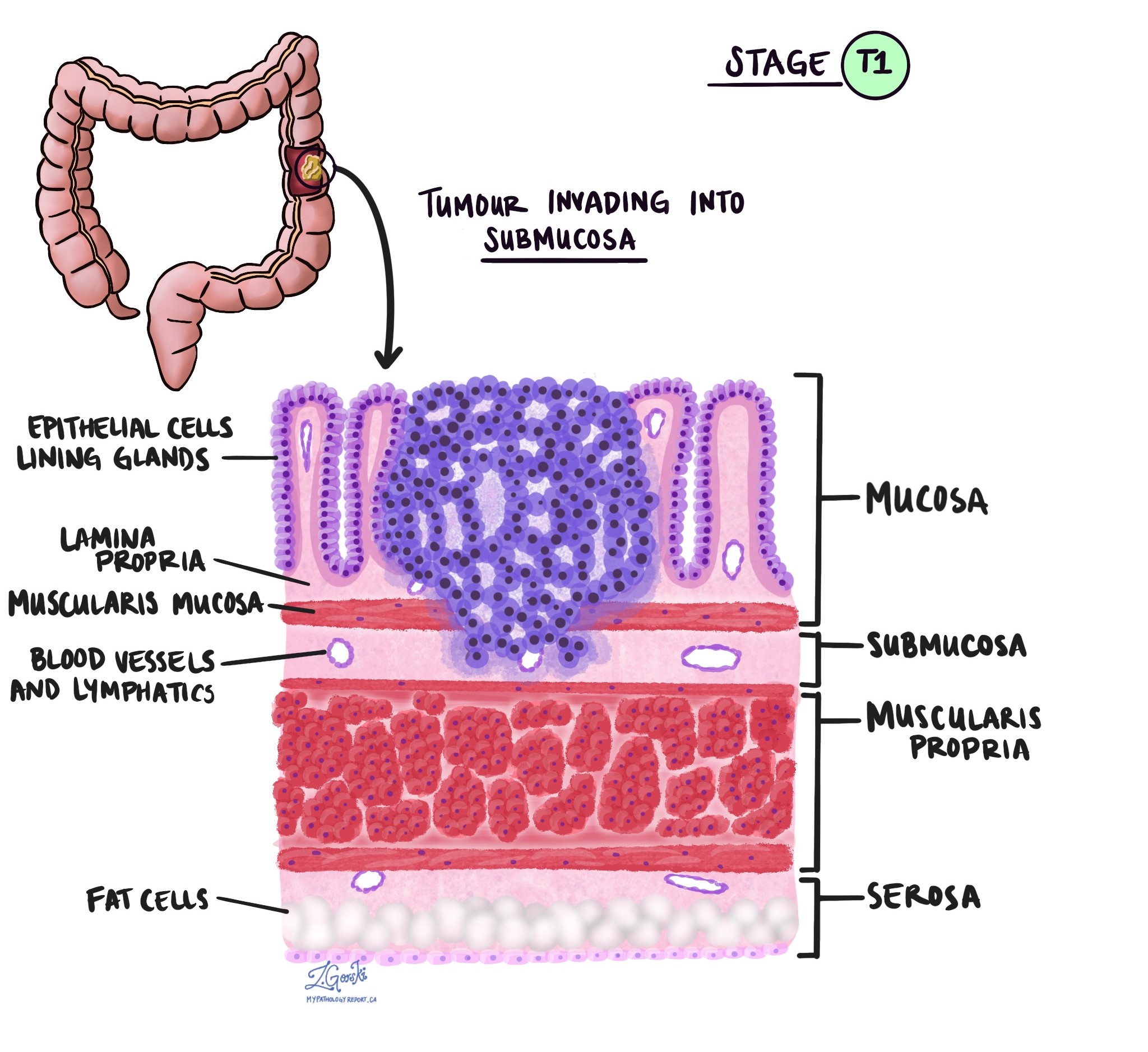
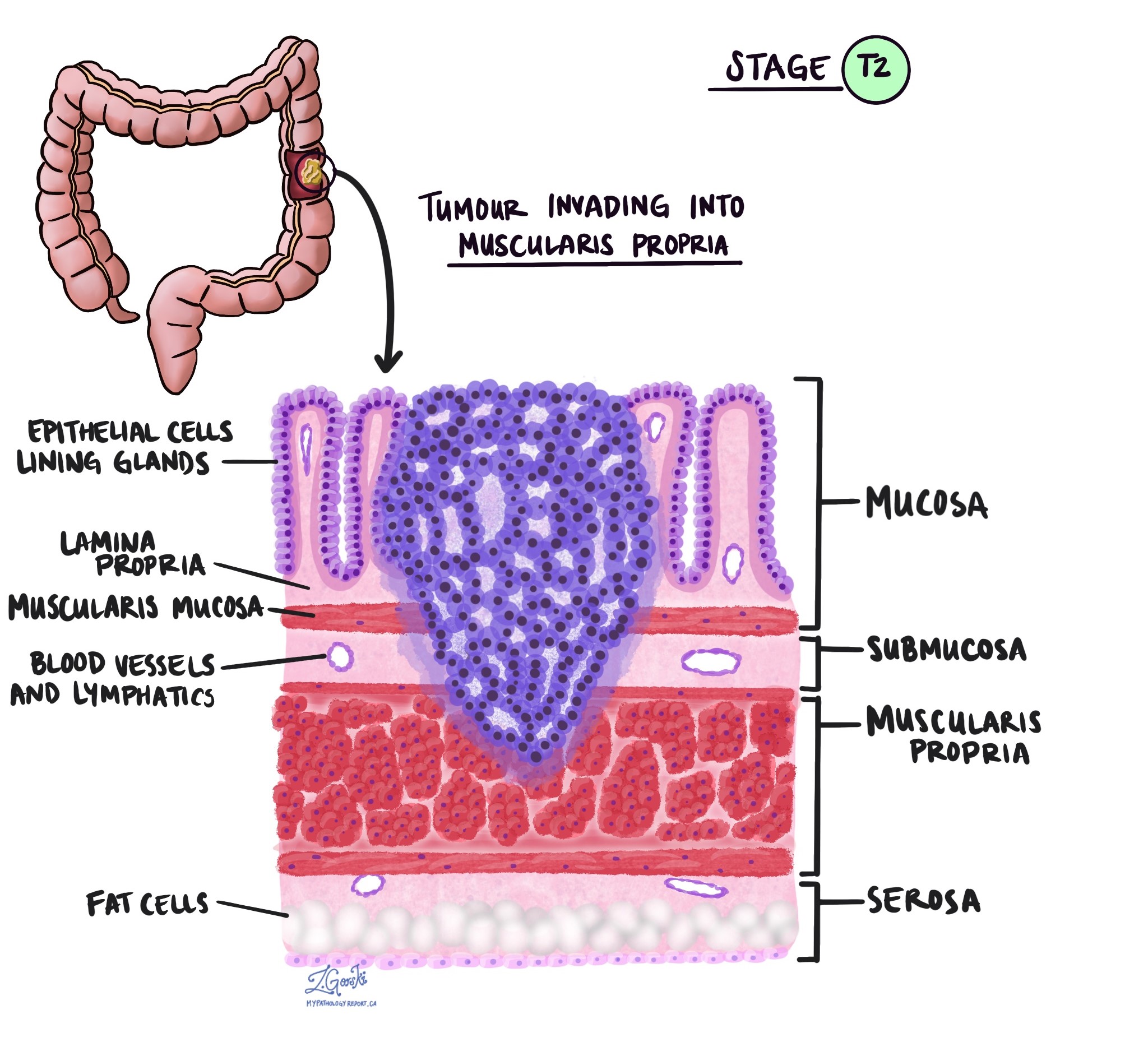
En pathologie, le terme invasion décrit la propagation des cellules cancéreuses dans les organes ou les tissus entourant l’endroit où la tumeur est apparue. Parce que l'adénocarcinome invasif du côlon commence dans une fine couche de tissu sur la surface interne du côlon appelée muqueuse, l’invasion est définie comme la propagation de cellules cancéreuses dans les autres couches de tissus du côlon ou dans tout autre organe extérieur au côlon. L’invasion n’est visible qu’après que la tumeur a été examinée au microscope par un pathologiste.
En examinant la tumeur au microscope, votre pathologiste verra dans quelle mesure les cellules cancéreuses se sont propagées de la muqueuse aux tissus environnants. C'est ce qu'on appelle la profondeur ou le niveau d'invasion. La profondeur de l'invasion est importante car les tumeurs qui envahissent plus profondément la paroi du côlon sont plus susceptibles de se propager à d'autres parties du corps, comme ganglions lymphatiques, le foie ou les poumons. Le niveau d’invasion est également utilisé pour déterminer le stade pathologique de la tumeur (pT). Les images ci-dessous montrent la relation entre la profondeur de l’invasion et le stade pathologique de la tumeur.
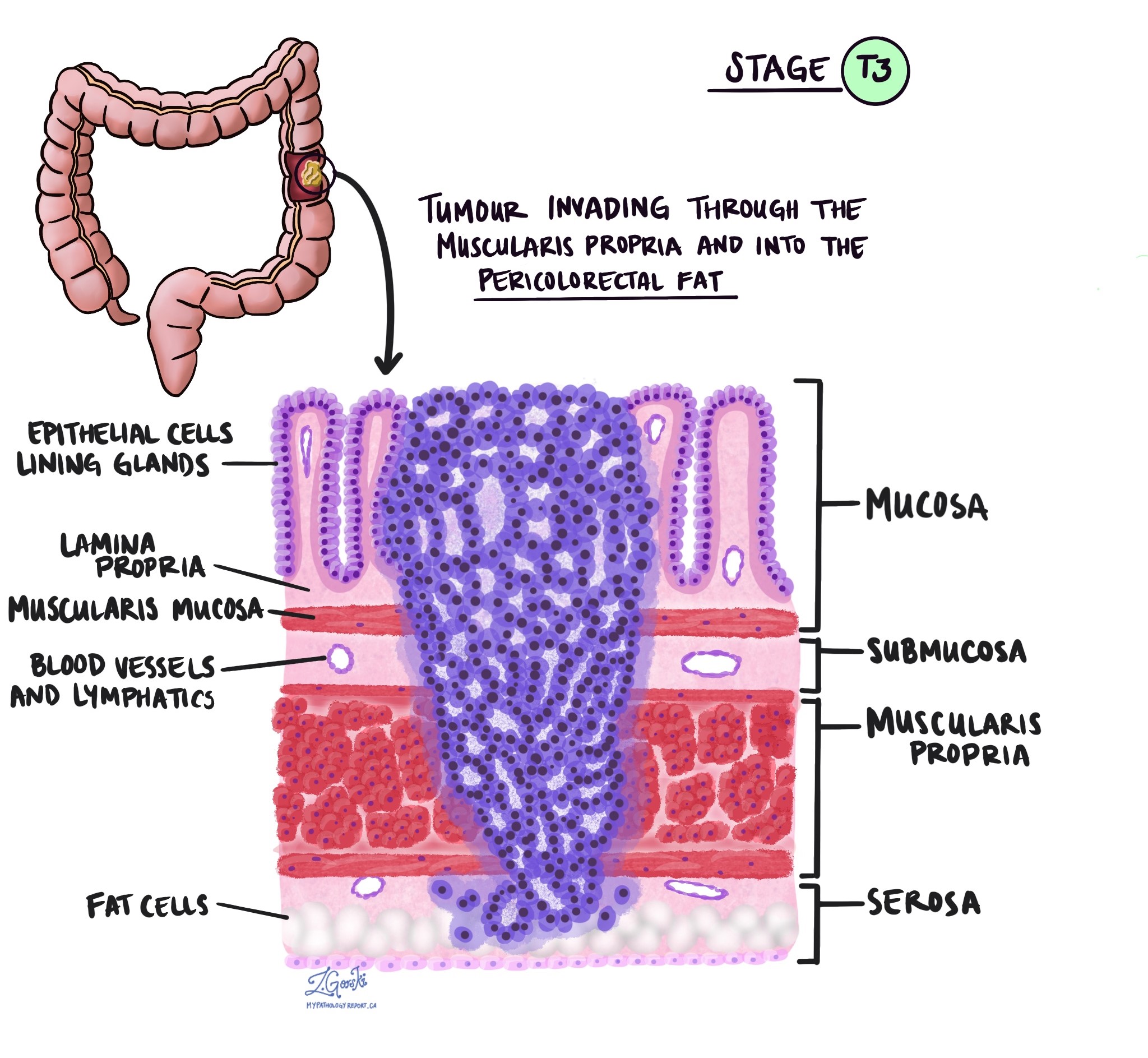
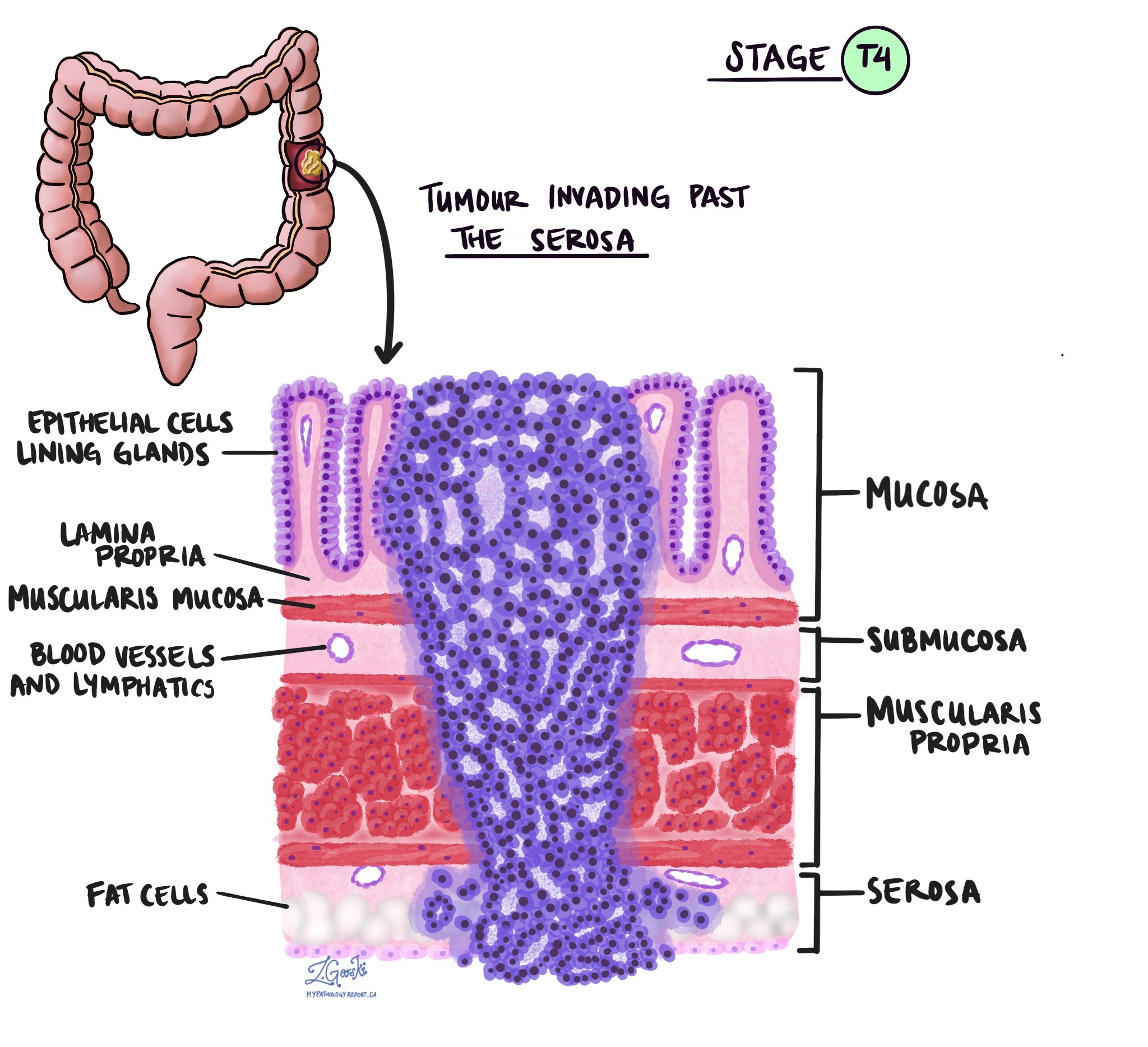
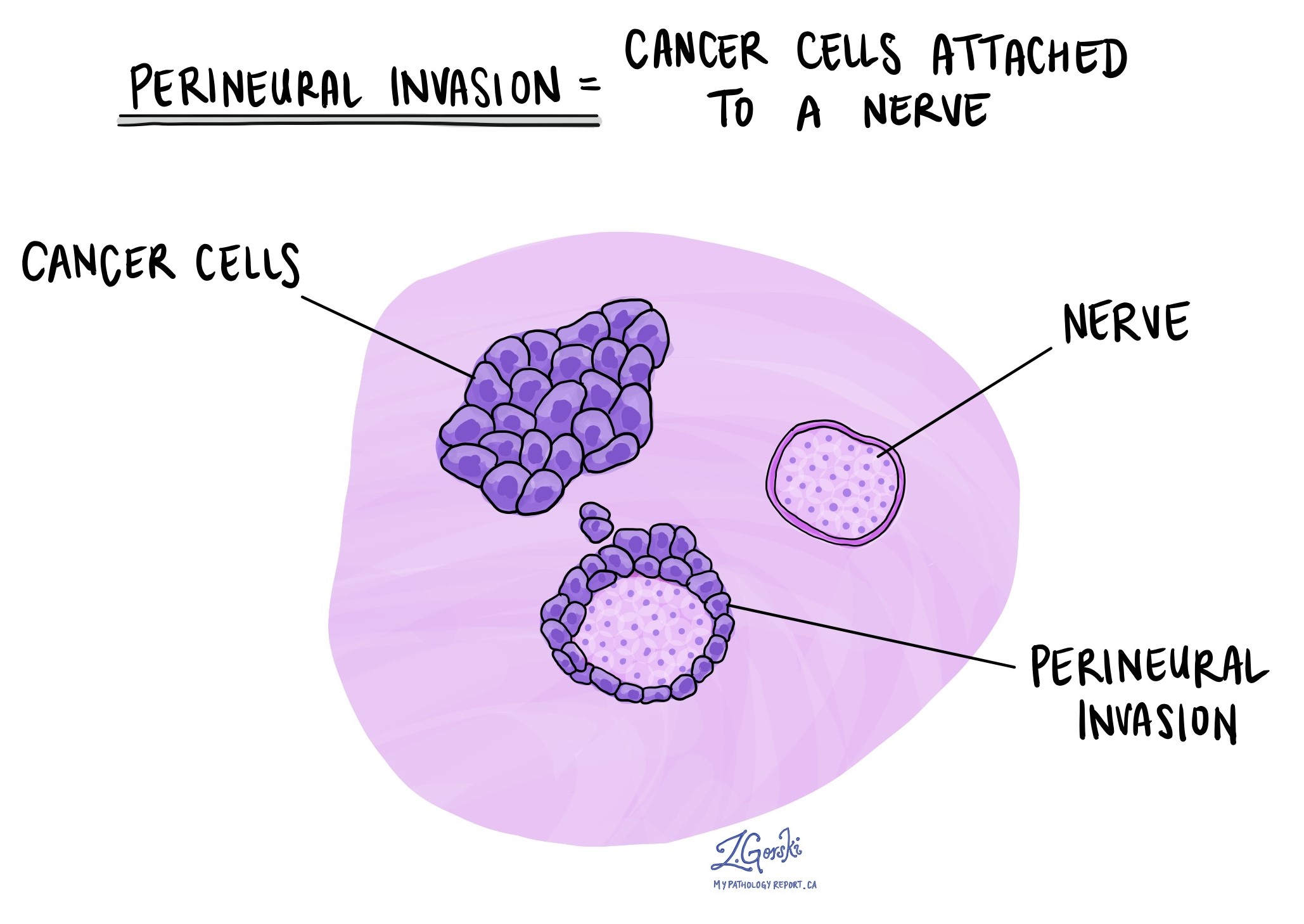
Invasion périneurale
Les pathologistes utilisent le terme « invasion périneurale » pour décrire une situation dans laquelle des cellules cancéreuses s’attachent à un nerf ou l’envahissent. « Invasion intraneurale » est un terme apparenté qui fait spécifiquement référence aux cellules cancéreuses trouvées à l'intérieur d'un nerf. Les nerfs, ressemblant à de longs fils, sont constitués de groupes de cellules appelées neurones. Ces nerfs, présents dans tout le corps, transmettent des informations telles que la température, la pression et la douleur entre le corps et le cerveau. La présence d’une invasion périneurale est importante car elle permet aux cellules cancéreuses de se déplacer le long du nerf jusqu’aux organes et tissus voisins, augmentant ainsi le risque de récidive de la tumeur après la chirurgie.
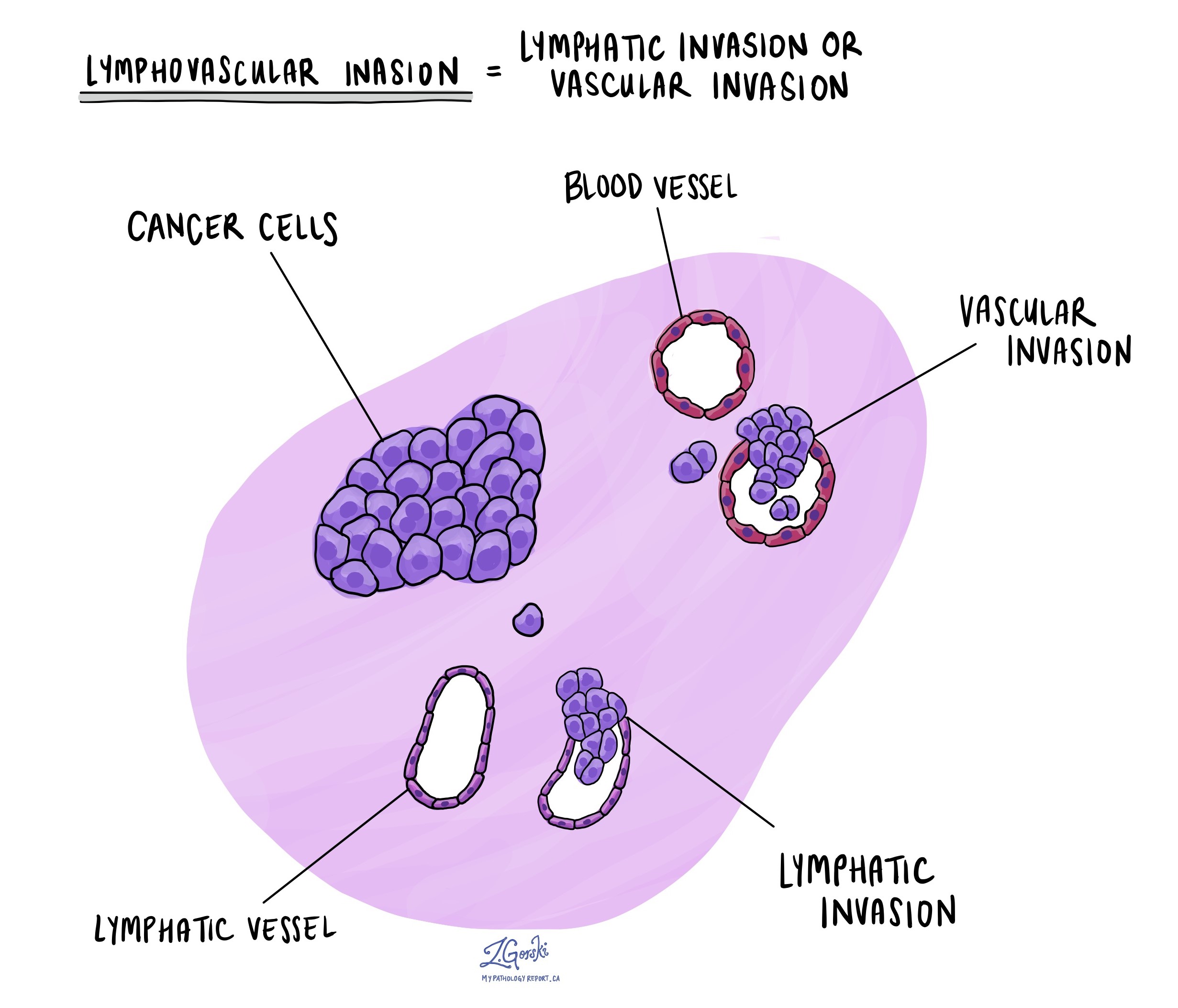
Invasion lymphovasculaire
L’invasion lymphovasculaire se produit lorsque des cellules cancéreuses envahissent un vaisseau sanguin ou lymphatique. Les vaisseaux sanguins sont de minces tubes qui transportent le sang dans tout le corps, tandis que les vaisseaux lymphatiques transportent un liquide appelé lymphe au lieu du sang. Ces vaisseaux lymphatiques se connectent à de petits organes immunitaires dispersés dans tout le corps, appelés ganglions lymphatiques.
L’invasion lymphovasculaire est importante car elle permet aux cellules cancéreuses de se propager à d’autres parties du corps, notamment les ganglions lymphatiques ou le foie, via les vaisseaux sanguins ou lymphatiques. De plus, la présence de cellules cancéreuses à l’intérieur d’une grosse veine située au-delà de la paroi du côlon (à l’extérieur de l’épais faisceau musculaire) est associée à un risque élevé que les cellules cancéreuses finissent par se retrouver dans le foie.
Marges
En pathologie, une marge est le bord du tissu retiré lors d’une chirurgie tumorale. L'état des marges dans un rapport de pathologie est important car il indique si la totalité de la tumeur a été retirée ou si une partie a été laissée. Ces informations aident à déterminer la nécessité d’un traitement supplémentaire.
Les pathologistes évaluent généralement les marges après une intervention chirurgicale comme un excision or résection, visant à éliminer la totalité de la tumeur. Les marges ne sont généralement pas évaluées après une biopsie, qui n'enlève qu'une partie de la tumeur. Le nombre de marges signalées et leur taille (la quantité de tissu normal entre la tumeur et le bord coupé) varient en fonction du type de tissu et de l'emplacement de la tumeur.
Les pathologistes examinent les marges pour vérifier si des cellules tumorales sont présentes au bord coupé du tissu. Une marge positive, là où se trouvent les cellules tumorales, suggère qu'un certain cancer peut persister dans le corps. En revanche, une marge négative, sans cellules tumorales au bord, suggère que la tumeur a été entièrement retirée. Certains rapports mesurent également la distance entre les cellules tumorales les plus proches et la marge, même si toutes les marges sont négatives.

Tumeur naissante
Le bourgeonnement tumoral est un terme que les pathologistes utilisent pour décrire soit des cellules cancéreuses uniques, soit de petits groupes de cellules cancéreuses observées au bord de la tumeur. On pense que c’est le signe que la tumeur devient moins différenciée. En fonction du nombre de bourgeons observés au microscope, un score est attribué, soit faible, intermédiaire ou élevé. Un score élevé est associé à un risque accru de propagation des cellules cancéreuses à une autre partie du corps.
Effet du traitement
Si vous avez reçu un traitement contre le cancer (chimiothérapie, radiothérapie ou les deux) avant l'ablation de la tumeur, votre pathologiste examinera attentivement la zone du tissu où la tumeur a été précédemment identifiée pour voir si des cellules cancéreuses sont encore vivantes (viables). Le système le plus couramment utilisé décrit l'effet du traitement sur une échelle de 0 à 3, 0 étant l'absence de cellules cancéreuses viables (toutes les cellules cancéreuses sont mortes) et 3 étant un cancer résiduel étendu sans régression apparente de la tumeur (la totalité ou la plupart des cellules cancéreuses sont mortes). les cellules cancéreuses sont vivantes).
Dépôt tumoral
Un dépôt tumoral est un groupe de cellules cancéreuses qui sont séparées de la tumeur principale mais pas dans un ganglion lymphatique. Les dépôts tumoraux sont associés à un risque plus élevé que les cellules tumorales se propagent à une autre partie du corps, comme le foie ou les poumons, après le traitement. Les dépôts tumoraux déterminent également le stade pathologique de la tumeur (pT).
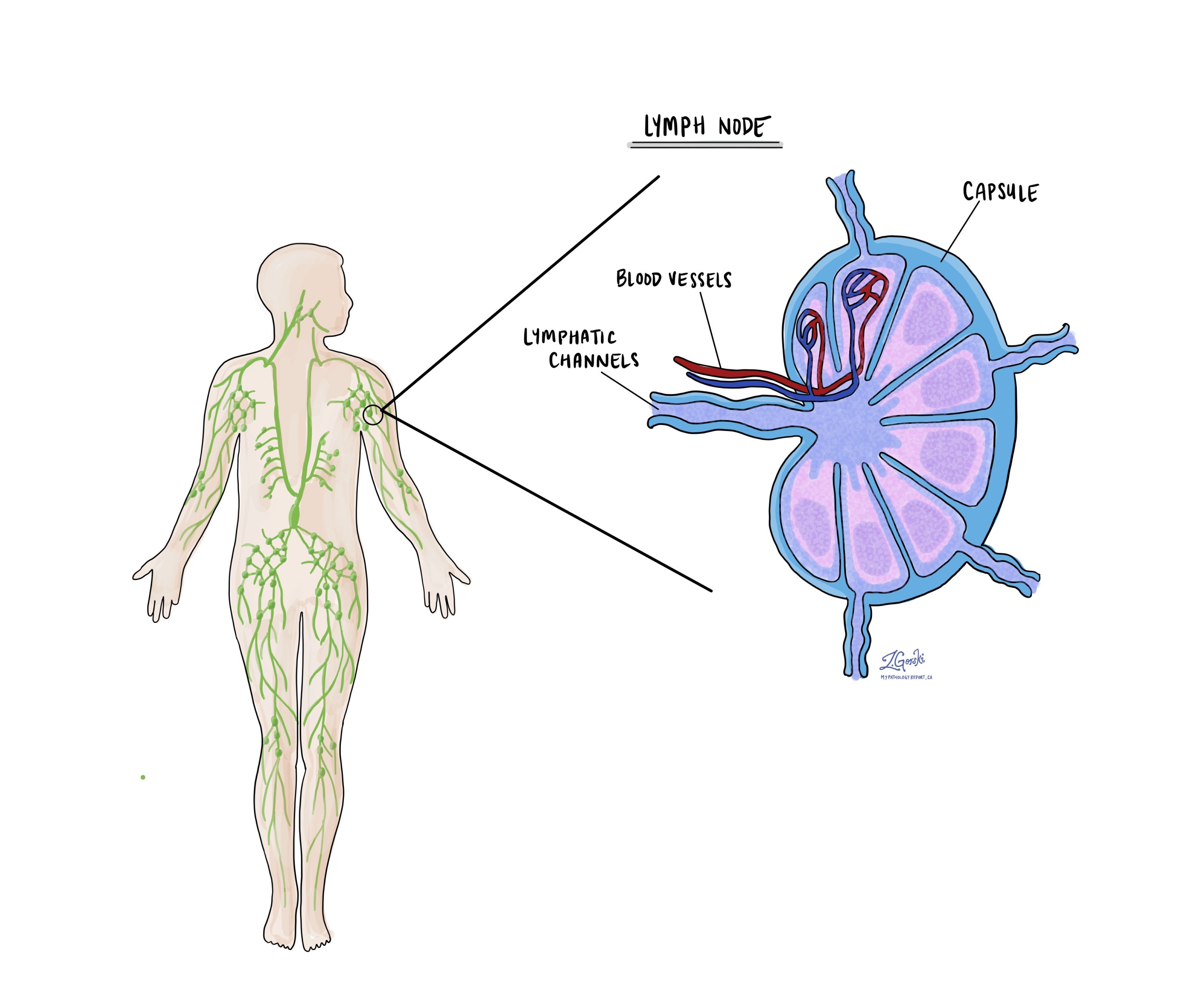
Ganglions lymphatiques
Les petits organes immunitaires, appelés ganglions lymphatiques, sont situés dans tout le corps. Les cellules cancéreuses peuvent voyager d’une tumeur vers ces ganglions lymphatiques via de minuscules vaisseaux lymphatiques. Pour cette raison, les médecins enlèvent et examinent souvent au microscope les ganglions lymphatiques à la recherche de cellules cancéreuses. Ce processus, par lequel les cellules cancéreuses se déplacent de la tumeur d'origine vers une autre partie du corps comme un ganglion lymphatique, est appelé métastase.
Les cellules cancéreuses migrent généralement d’abord vers les ganglions lymphatiques proches de la tumeur, bien que les ganglions lymphatiques distants puissent également être affectés. Par conséquent, les chirurgiens retirent généralement en premier les ganglions lymphatiques les plus proches de la tumeur. Ils pourraient retirer les ganglions lymphatiques plus éloignés de la tumeur s’ils sont hypertrophiés et s’il y a de fortes suspicions qu’ils contiennent des cellules cancéreuses.
Les pathologistes examineront tous les ganglions lymphatiques retirés au microscope et les résultats seront détaillés dans votre rapport. Un résultat « positif » indique la présence de cellules cancéreuses dans le ganglion lymphatique, tandis qu'un résultat « négatif » signifie qu'aucune cellule cancéreuse n'a été trouvée. Si le rapport détecte des cellules cancéreuses dans un ganglion lymphatique, il peut également préciser la taille du plus grand amas de ces cellules, souvent appelé « foyer » ou « dépôt ». L'extension extraganglionnaire se produit lorsque les cellules tumorales pénètrent dans la capsule externe du ganglion lymphatique et se propagent dans les tissus adjacents.
L'examen des ganglions lymphatiques est important pour deux raisons. Premièrement, cela permet de déterminer le stade ganglionnaire pathologique (pN). Deuxièmement, la découverte de cellules cancéreuses dans un ganglion lymphatique suggère un risque accru de détecter ultérieurement des cellules cancéreuses dans d’autres parties du corps. Ces informations guident votre médecin dans la décision si vous avez besoin de traitements supplémentaires, tels que la chimiothérapie, la radiothérapie ou l'immunothérapie.
Protéines de réparation des mésappariements
La réparation des mésappariements (MMR) est un système présent à l'intérieur de toutes les cellules normales et saines qui corrige les erreurs de notre matériel génétique (ADN). Le système est composé de différentes protéines, les quatre plus courantes étant MSH2, MSH6, MLH1 et PMS2.
Les quatre protéines de réparation des mésappariements MSH2, MSH6, MLH1 et PMS2 travaillent par paires pour réparer l'ADN endommagé. Plus précisément, MSH2 fonctionne avec MSH6 et MLH1 fonctionne avec PMS2. Si une protéine est perdue, la paire ne peut pas fonctionner normalement et le risque de développer un cancer augmente.
Comment les pathologistes testent-ils les protéines de réparation des mésappariements ?
La manière la plus courante de tester les protéines de réparation des mésappariements est immunohistochimie. Ce test permet aux pathologistes de voir si les cellules tumorales produisent les quatre protéines de réparation des mésappariements. Les résultats de ce test sont généralement rapportés comme suit :
- Résultat normal : expression protéique conservée.
- Résultat anormal : Perte d’expression des protéines.
Pourquoi est-il important de tester les protéines de réparation des mésappariements ?
Les tests de réparation des disparités sont importants car ils peuvent aider à prédire l’efficacité de certains traitements. Par exemple, les cancers présentant une perte d’expression des protéines de réparation des mésappariements sont plus susceptibles de répondre aux traitements d’immunothérapie tels que les inhibiteurs de PD-1 ou de PD-L1. En effet, le nombre élevé de mutations souvent observées dans les tumeurs déficientes peut produire de nouveaux antigènes qui rendent la tumeur plus visible et plus vulnérable pour le système immunitaire.
Des tests de réparation des mésappariements sont également effectués pour identifier les patients susceptibles d'être atteints du syndrome de Lynch, également connu sous le nom de cancer colorectal héréditaire sans polypose (HNPCC). Le syndrome de Lynch est une maladie génétique qui augmente le risque de développer divers types de cancer, notamment le cancer de l'œsophage, le cancer du côlon, le cancer de l'endomètre, le cancer des ovaires et le cancer de l'estomac.
Autres modifications génétiques trouvées dans l'adénocarcinome invasif du côlon et du rectum
- Mutations du gène APC (Adenomatous Polyposis Coli) : Presque omniprésentes dans les cas sporadiques de cancer du côlon, les mutations du gène APC sont souvent un événement précoce dans le développement du cancer colorectal. Le gène APC est un gène suppresseur de tumeur et son inactivation entraîne une croissance cellulaire anormale.
- Mutations KRAS et NRAS : Des mutations dans les gènes KRAS et NRAS, qui font partie de la famille des gènes RAS, surviennent dans environ 40 à 45 % des cancers colorectaux. Ces mutations conduisent à une division et une croissance cellulaire incontrôlées. La présence de mutations KRAS, en particulier, est associée à une résistance à certaines thérapies anti-EGFR (récepteur du facteur de croissance épidermique).
- Mutations BRAF : La mutation du gène BRAF, en particulier V600E, est retrouvée dans environ 10 % des cancers colorectaux. Elle est souvent associée à un mauvais pronostic et à une résistance à certains traitements. Les mutations BRAF sont plus fréquentes dans les cancers qui se sont développés par la voie dentelée.
- Mutations PIK3CA : Des mutations du gène PIK3CA, qui code pour une sous-unité de la phosphatidylinositol 3-kinase (PI3K), surviennent dans environ 10 à 20 % des cancers colorectaux. Ces mutations peuvent activer la voie de signalisation AKT, favorisant ainsi la prolifération et la survie cellulaire.
Tests utilisés pour détecter les changements génétiques
- Séquençage de nouvelle génération (NGS) : NGS permet l’examen simultané de plusieurs gènes pour détecter des mutations, des délétions et des amplifications. Cette approche globale permet d'évaluer toutes les altérations génétiques courantes du cancer colorectal, notamment les mutations APC, KRAS, NRAS, BRAF et PIK3CA.
- Réaction en chaîne par polymérase (PCR) : Cette technique amplifie des segments d'ADN, permettant d'analyser des changements génétiques spécifiques, tels que les mutations KRAS, NRAS et BRAF.
- Hybridation in situ par fluorescence (FISH) : FISH peut identifier des anomalies génétiques telles que des amplifications ou des délétions au sein de gènes spécifiques. Il est moins couramment utilisé pour la détection de routine des changements génétiques mentionnés, mais peut être utile dans des contextes spécifiques.
A propos de cet article
Les médecins ont rédigé cet article pour vous aider à lire et à comprendre votre rapport de pathologie. Nous contacter si vous avez des questions sur cet article ou sur votre rapport de pathologie. Pour une introduction complète à votre rapport de pathologie, lisez cet article.