von Jason Wasserman MD PhD FRCPC und Zuzanna Gorski MD
15. Januar 2024
Das invasive Adenokarzinom (auch Kolonadenokarzinom genannt) ist die häufigste Art von Dickdarmkrebs. Es besteht aus Zellen, die normalerweise die Innenfläche des Dickdarms bedecken. Diese Art von Krebs beginnt oft in einem Polypen wie z tubuläres Adenom, tubulovillöses Adenom, oder villöses Adenom.
Dieser Artikel hilft Ihnen, Ihre Diagnose und Ihren Pathologiebericht für ein invasives Adenokarzinom des Dickdarms zu verstehen.
Der Doppelpunkt
Der Dickdarm ist Teil des Verdauungssystems und der erste Teil des Dickdarms. Es handelt sich um einen langen hohlen Schlauch, der am Ende des Dünndarms beginnt und am Rektum endet. Der Dickdarm ist in vier Teile unterteilt: aufsteigend (rechts), quer, absteigend (links) und sigmoid. Es spielt eine entscheidende Rolle bei der Verarbeitung von Abfallprodukten und der Aufnahme von Wasser, Elektrolyten und einigen Vitaminen. Invasive Adenokarzinome können in jedem Teil des Dickdarms auftreten.
Was verursacht ein invasives Adenokarzinom im Dickdarm?
Es wird angenommen, dass ein invasives Adenokarzinom im Dickdarm durch eine Kombination aus Umwelt- und genetischen Faktoren verursacht wird. Zu den etablierten Risikofaktoren zählen übermäßiger Verzehr von verarbeitetem Fleisch, rotem Fleisch und Alkohol. Auch Menschen mit überschüssigem Körperfett haben ein erhöhtes Risiko, an dieser Krebsart zu erkranken. Verlängert Entzündung im Dickdarm, die bei entzündlichen Darmerkrankungen (Colitis ulcerosa und Morbus Crohn) auftreten kann, ist auch mit einem erhöhten Risiko für die Entwicklung eines invasiven Adenokarzinoms verbunden.
Was sind die Symptome eines invasiven Adenokarzinoms des Dickdarms?
Die Symptome eines invasiven Adenokarzinoms hängen von der Lage des Tumors im Dickdarm ab. Tumoren im linken Dickdarm (absteigender Dickdarm) oder im Rektum können zu Veränderungen der Stuhlgewohnheiten, blutigem Stuhl, Bauchschmerzen oder Blähungen führen. Tumore im rechten Dickdarm (aufsteigender Dickdarm) verursachen möglicherweise keine Symptome, bis der Tumor sehr groß ist oder sich auf andere Körperteile ausgebreitet hat.
Wo im Dickdarm beginnt das invasive Adenokarzinom?
Es entsteht ein invasives Adenokarzinom des Dickdarms Epithelzellen findet sich normalerweise an der Innenseite des Dickdarms. Diese Epithelzellen verbinden sich zu sogenannten Strukturen Drüsen. Die Drüsen bilden zusammen mit der darunter liegenden Lamina propria und Muscularis mucosae eine dünne Gewebeschicht, die Schleimhaut genannt wird. Befinden sich die Tumorzellen vollständig in der Schleimhaut, spricht man von einem Tumor hochgradige Dysplasie.
Eine hochgradige Dysplasie wird als nichtinvasive, präkanzeröse Erkrankung angesehen, und die Tumorzellen können dies nicht tun metastasieren (Ausbreitung) auf andere Körperteile. Wenn der Tumor jedoch wächst und die Zellen in die darunter liegenden Gewebeschichten eindringen, ändert sich die Diagnose auf invasives Adenokarzinom. Im Gegensatz zur hochgradigen Dysplasie können die Tumorzellen beim invasiven Karzinom metastasieren (sich ausbreiten). Lymphknoten und andere Körperteile.

Mikroskopische Merkmale dieses Tumors
Bei mikroskopischer Untersuchung besteht das invasive Adenokarzinom des Dickdarms aus Gruppen abnormaler Epithelzellen typischerweise in gleichbleibender Größe angeordnet Drüsen (die den normalen Drüsen im Dickdarm ähneln können), Nestern oder Blättern.
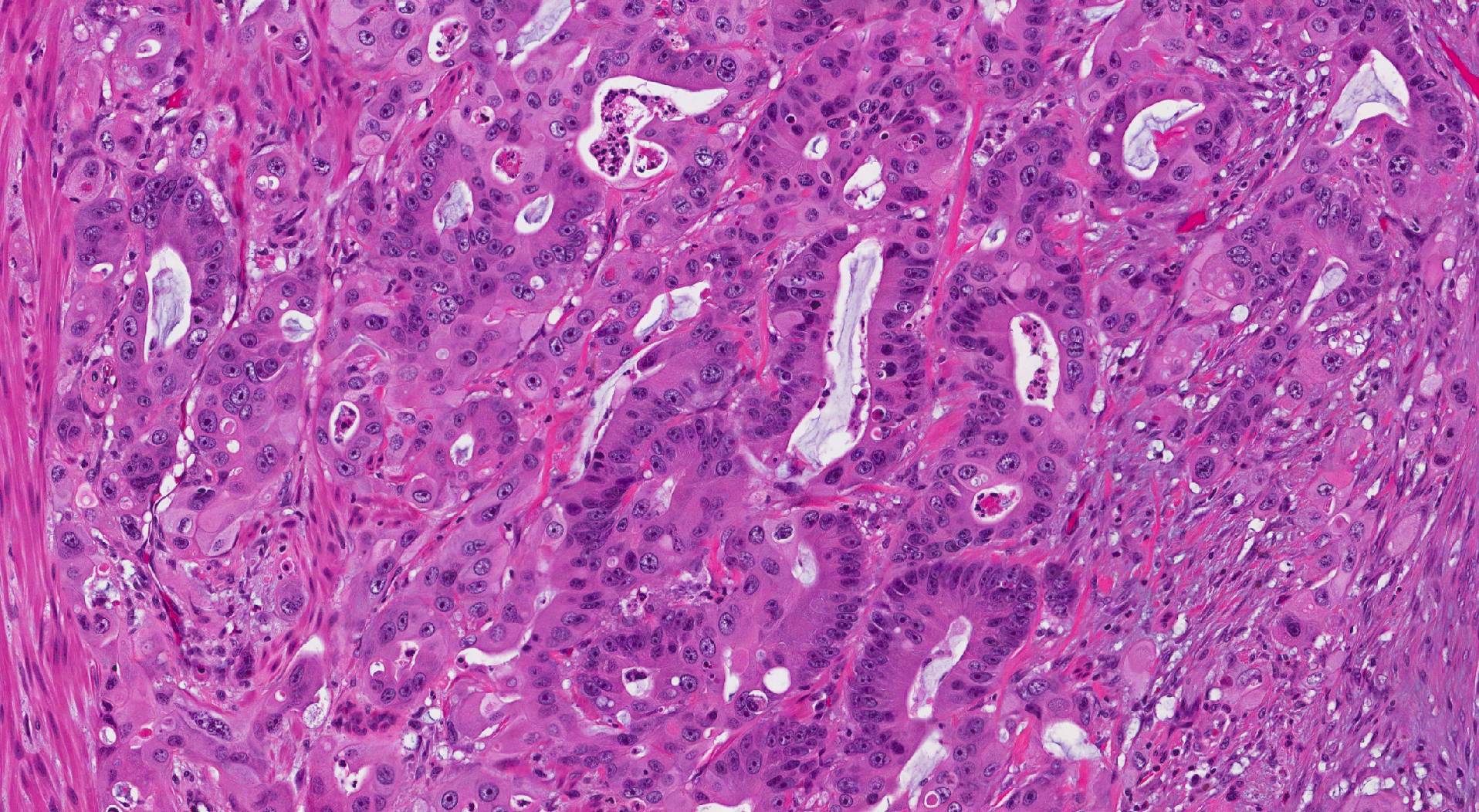
Worauf Sie in Ihrem Pathologiebericht für ein invasives Adenokarzinom des Dickdarms achten sollten:
Schleimige Differenzierung
Pathologen verwenden den Begriff „muzinöse Differenzierung“, um Tumore zu beschreiben, die eine große Menge extrazellulärer Substanzen enthalten Mucin. Mucin ist eine spezialisierte Proteinart, die sowohl von normalen Zellen als auch von Tumorzellen hergestellt wird. Extrazellulär bedeutet, dass das Mucin außerhalb der Tumorzellen gesehen wurde. Wenn mehr als 50 % des Tumors aus Mucin bestehen, spricht man von einem Tumor muzinöses Adenokarzinom.
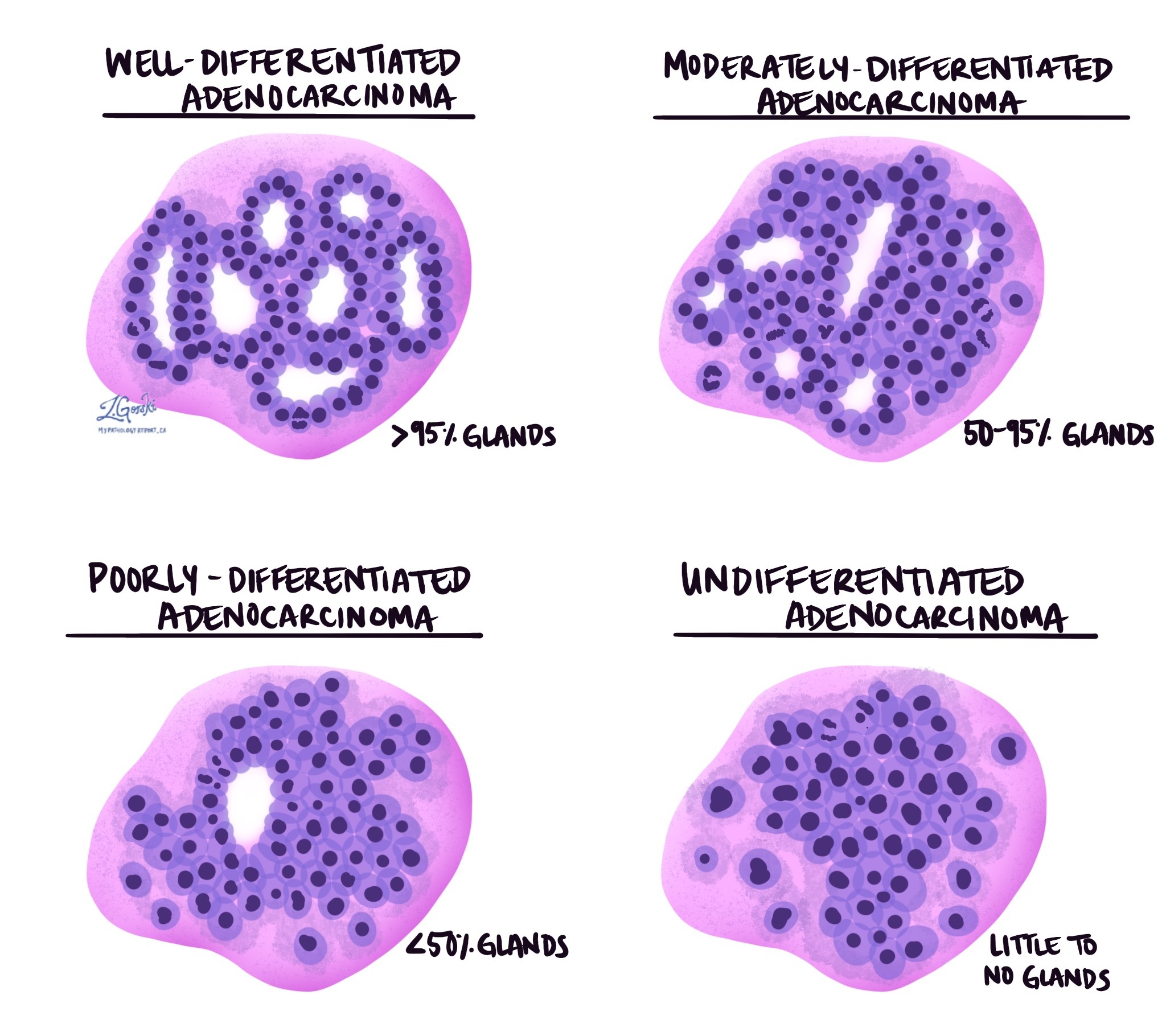
Histologischer Grad
Das invasive Adenokarzinom des Dickdarms wird in drei Grade eingeteilt – gut differenziert, mäßig differenziert und schlecht differenziert. Der Grad wird anhand des Prozentsatzes der Tumorzellen ermittelt, die runde Strukturen bilden Drüsen. Ein Tumor, der keine Drüsen bildet, wird als undifferenziert bezeichnet. Der Grad ist wichtig, da sich schlecht differenzierte und undifferenzierte Tumoren tendenziell aggressiver verhalten; Beispielsweise ist es wahrscheinlicher, dass sich diese Tumore ausbreiten Lymphknoten und andere Körperteile.
- Gut differenziert: Mehr als 95 % des Tumors bestehen aus Drüsen. Pathologen bezeichnen diese Tumoren auch als Grad 1.
- Mäßig differenziert: 50 bis 95 % des Tumors bestehen aus Drüsen. Pathologen bezeichnen diese Tumoren auch als Grad 2.
- Schlecht differenziert: Weniger als 50 % des Tumors bestehen aus Drüsen. Pathologen bezeichnen diese Tumoren auch als Grad 3.
- Undifferenziert: Im Tumor sind nur sehr wenige Drüsen zu sehen.
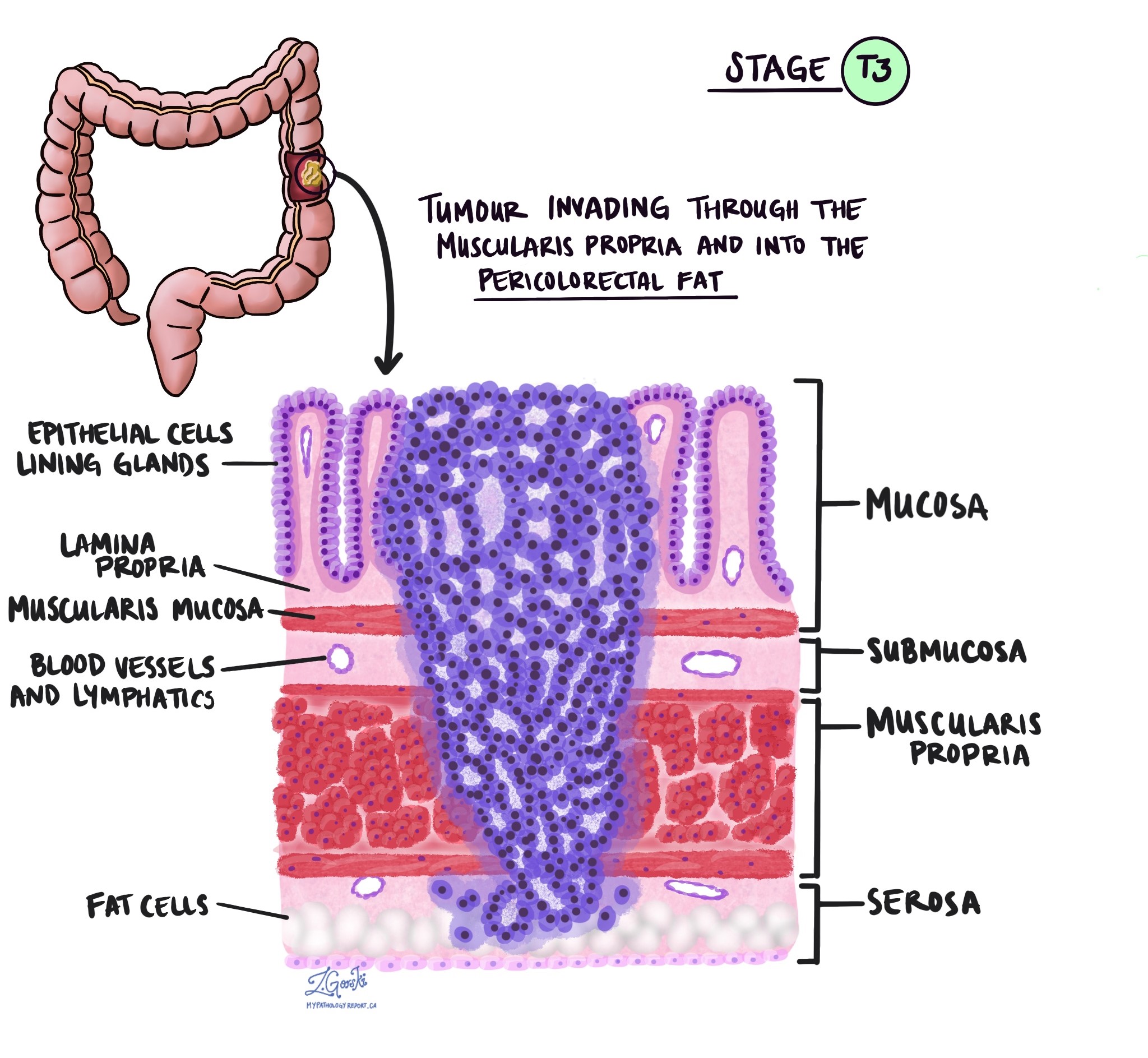
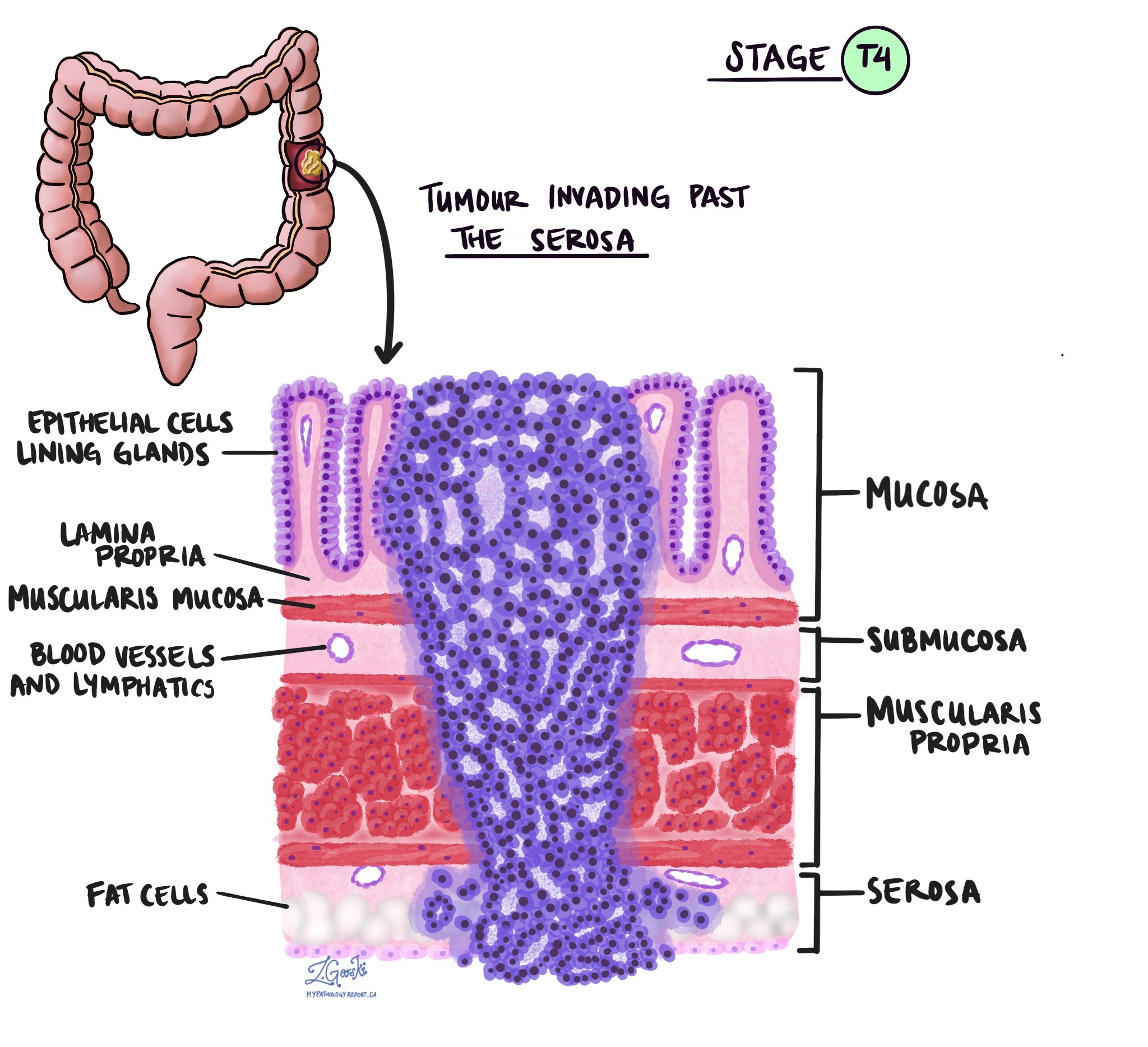
Invasionstiefe und pathologisches Tumorstadium (pT)
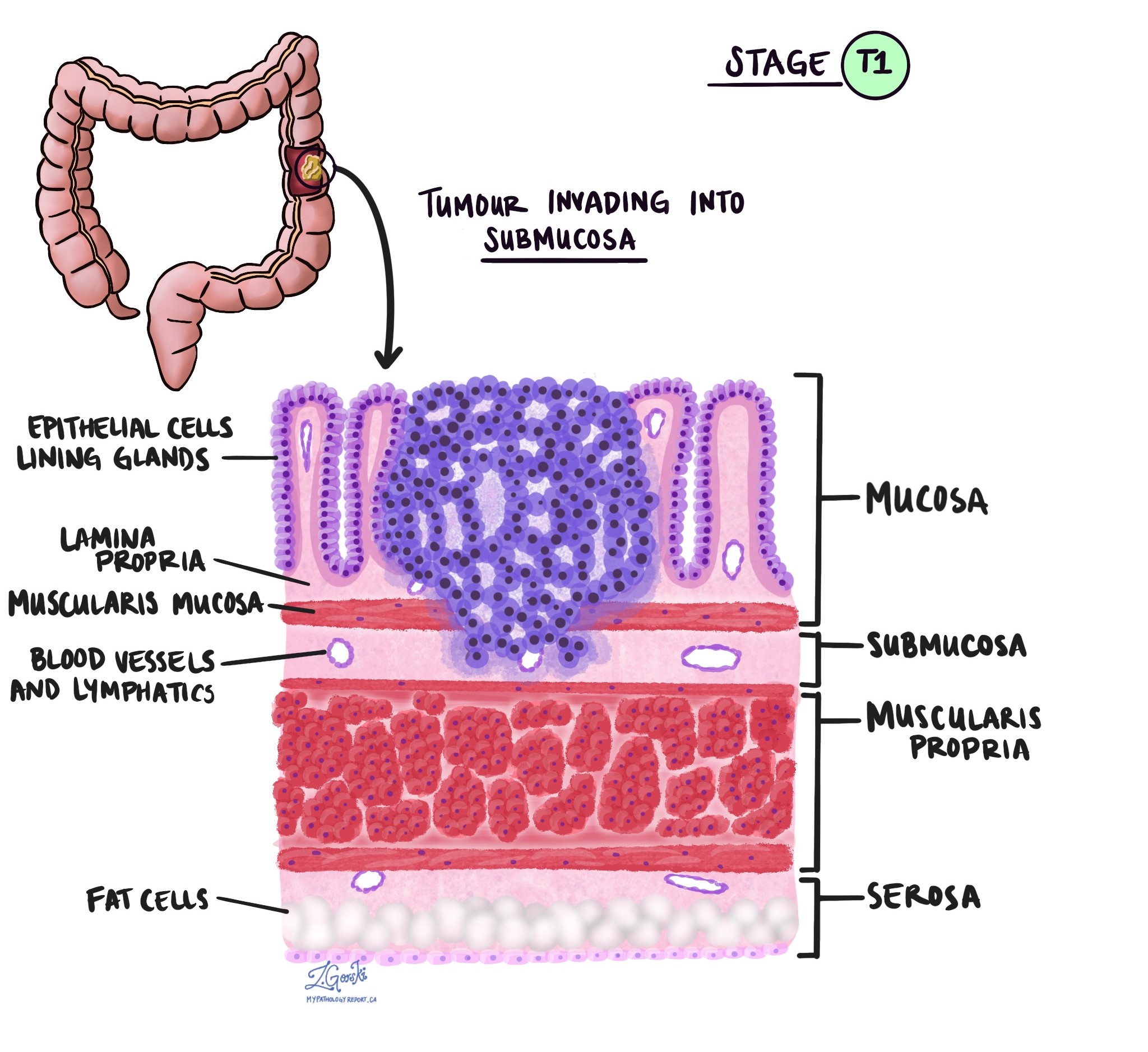
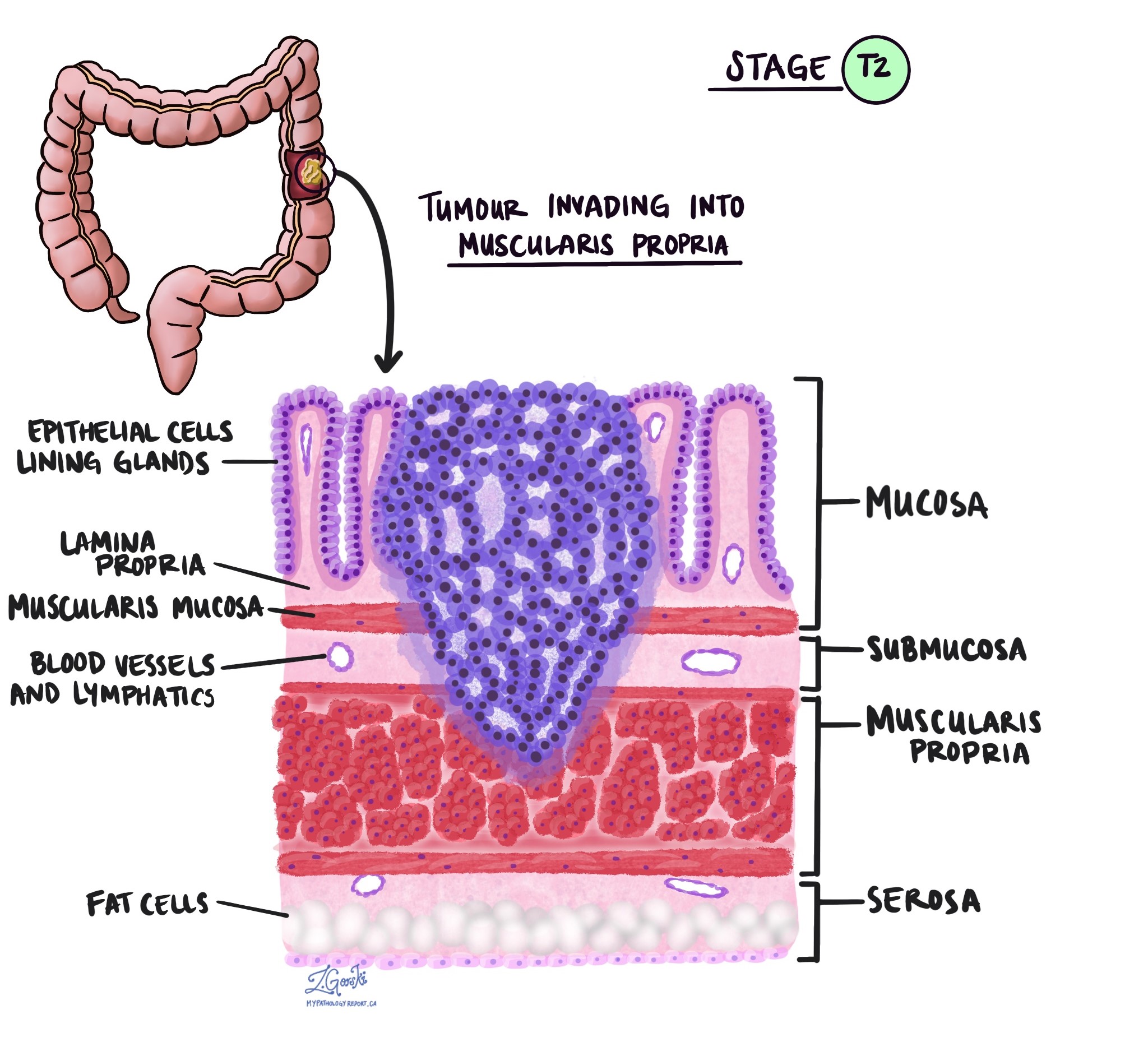
In der Pathologie der Begriff Invasion beschreibt die Ausbreitung von Krebszellen in Organe oder Gewebe rund um den Ort, an dem der Tumor entstanden ist. Denn das invasive Adenokarzinom des Dickdarms beginnt in einer dünnen Gewebeschicht an der Innenfläche des Dickdarms, der sog SchleimhautUnter Invasion versteht man die Ausbreitung von Krebszellen in die anderen Gewebeschichten im Dickdarm oder in andere Organe außerhalb des Dickdarms. Eine Invasion kann erst erkannt werden, nachdem der Tumor von einem Pathologen unter dem Mikroskop untersucht wurde.
Bei der Untersuchung des Tumors unter dem Mikroskop erkennt Ihr Pathologe, wie weit sich die Krebszellen von der Schleimhaut in das umliegende Gewebe ausgebreitet haben. Dies wird als Tiefe oder Grad der Invasion bezeichnet. Die Invasionstiefe ist wichtig, da sich Tumore, die tiefer in die Dickdarmwand eindringen, eher auf andere Körperteile ausbreiten, z Lymphknoten, die Leber oder die Lunge. Der Invasionsgrad wird auch zur Bestimmung des pathologischen Tumorstadiums (pT) herangezogen. Die folgenden Bilder zeigen den Zusammenhang zwischen der Invasionstiefe und dem pathologischen Tumorstadium.
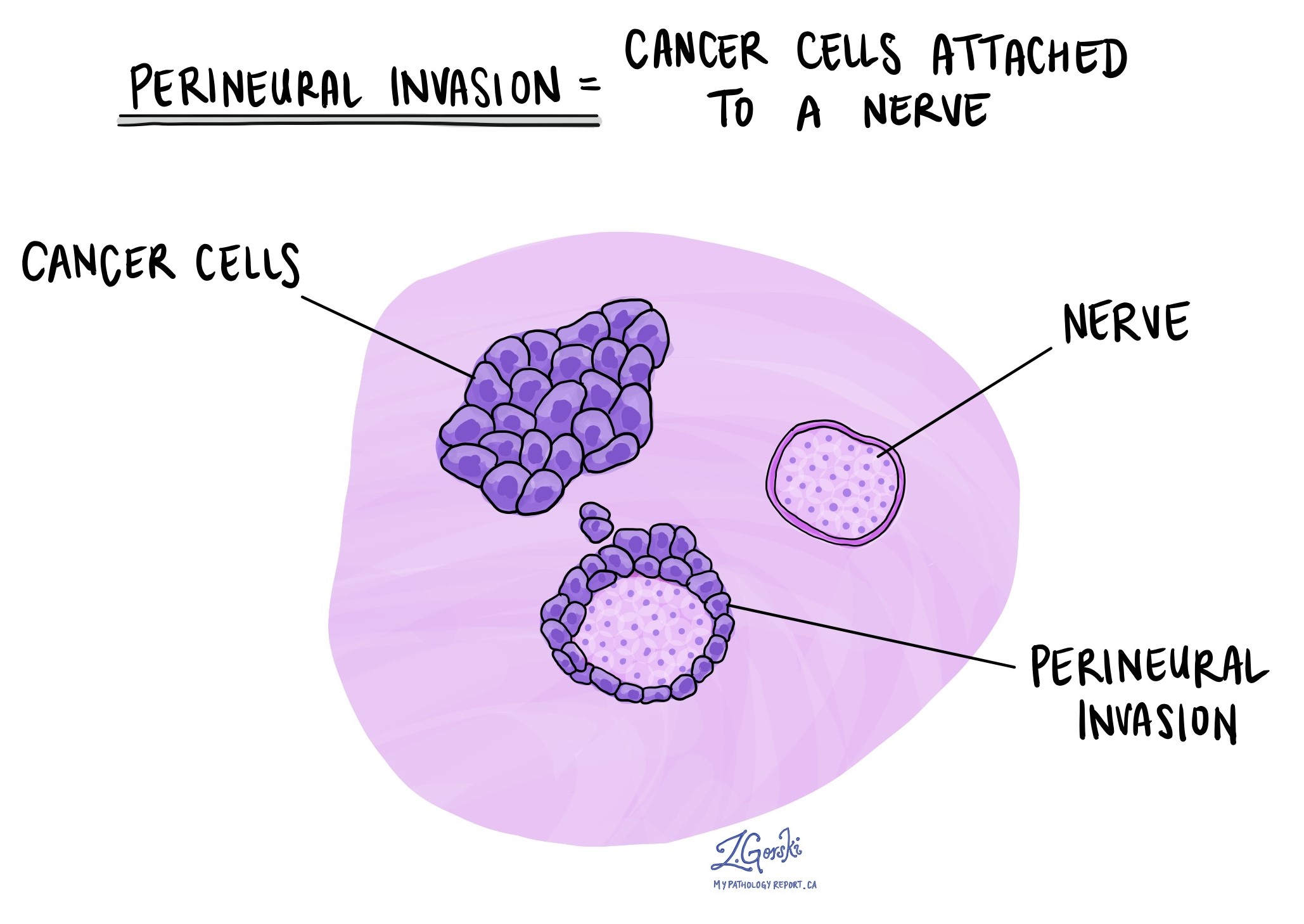
Perineurale Invasion
Pathologen verwenden den Begriff „perineurale Invasion“, um eine Situation zu beschreiben, in der sich Krebszellen an einen Nerv anheften oder in ihn eindringen. „Intraneurale Invasion“ ist ein verwandter Begriff, der sich speziell auf Krebszellen bezieht, die sich im Inneren eines Nervs befinden. Nerven ähneln langen Drähten und bestehen aus Zellgruppen, die als Neuronen bezeichnet werden. Diese im ganzen Körper verteilten Nerven übertragen Informationen wie Temperatur, Druck und Schmerz zwischen dem Körper und dem Gehirn. Das Vorhandensein einer perineuralen Invasion ist wichtig, da dadurch Krebszellen entlang des Nervs in benachbarte Organe und Gewebe gelangen können, was das Risiko eines erneuten Auftretens des Tumors nach der Operation erhöht.
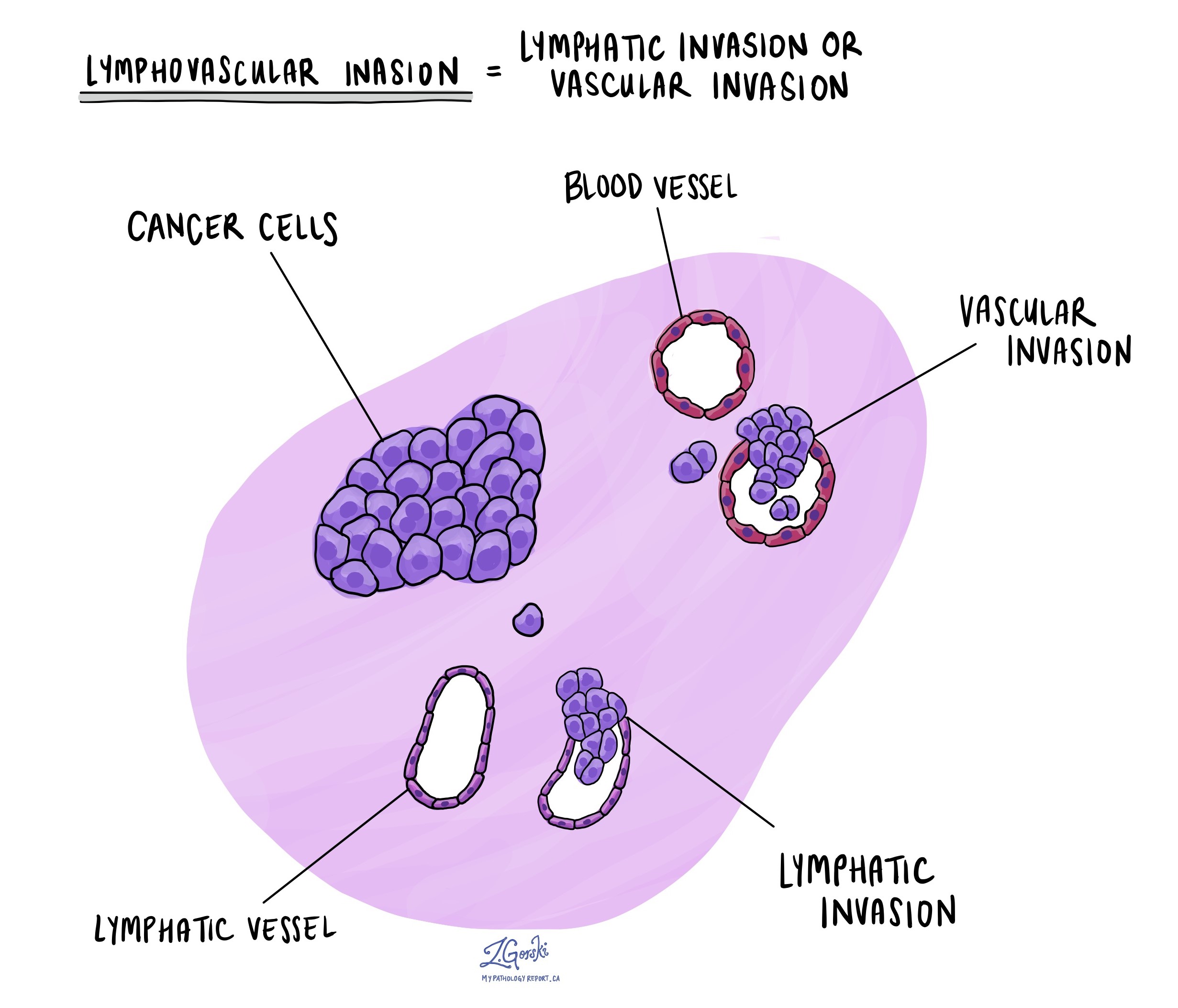
Lymphovaskuläre Invasion
Eine lymphovaskuläre Invasion tritt auf, wenn Krebszellen in ein Blutgefäß oder Lymphgefäß eindringen. Blutgefäße sind dünne Schläuche, die Blut durch den Körper transportieren, während Lymphgefäße anstelle von Blut eine Flüssigkeit namens Lymphe transportieren. Diese Lymphgefäße sind mit kleinen Immunorganen verbunden, die im ganzen Körper verstreut sind Lymphknoten.
Die lymphovaskuläre Invasion ist wichtig, da sie es Krebszellen ermöglicht, sich über das Blut oder die Lymphgefäße auf andere Körperteile, einschließlich Lymphknoten oder die Leber, auszubreiten. Darüber hinaus ist das Vorhandensein von Krebszellen in einer großen Vene jenseits der Dickdarmwand (außerhalb des dicken Muskelbündels) mit einem hohen Risiko verbunden, dass die Krebszellen schließlich in der Leber gefunden werden.
Margen
In der Pathologie ist ein Rand der Rand des Gewebes, das während einer Tumoroperation entfernt wird. Der Randstatus in einem Pathologiebericht ist wichtig, da er angibt, ob der gesamte Tumor entfernt wurde oder ob etwas zurückgeblieben ist. Diese Informationen helfen bei der Feststellung der Notwendigkeit einer weiteren Behandlung.
Pathologen beurteilen in der Regel die Ränder nach einem chirurgischen Eingriff wie einem Exzision or Resektion, mit dem Ziel, den gesamten Tumor zu entfernen. Margen werden normalerweise nicht nach a bewertet Biopsie, wodurch nur ein Teil des Tumors entfernt wird. Die Anzahl der gemeldeten Ränder und ihre Größe – wie viel normales Gewebe sich zwischen dem Tumor und der Schnittkante befindet – variieren je nach Gewebetyp und Tumorlokalisation.
Pathologen untersuchen Ränder, um zu überprüfen, ob an der Schnittkante des Gewebes Tumorzellen vorhanden sind. Ein positiver Bereich, in dem Tumorzellen gefunden werden, deutet darauf hin, dass möglicherweise etwas Krebs im Körper verbleibt. Im Gegensatz dazu deutet ein negativer Rand ohne Tumorzellen am Rand darauf hin, dass der Tumor vollständig entfernt wurde. Einige Berichte messen auch den Abstand zwischen den nächstgelegenen Tumorzellen und dem Rand, selbst wenn alle Ränder negativ sind.

Tumorknospung
Mit dem Begriff „Tumorknospen“ beschreiben Pathologen entweder einzelne Krebszellen oder kleine Gruppen von Krebszellen, die am Rand des Tumors sichtbar sind. Es wird angenommen, dass dies ein Zeichen dafür ist, dass der Tumor weniger differenziert ist. Basierend auf der Anzahl der unter dem Mikroskop sichtbaren Knospen wird eine Bewertung entweder niedrig, mittel oder hoch vergeben. Ein hoher Wert geht mit einem erhöhten Risiko einher, dass sich Krebszellen in einen anderen Teil des Körpers ausbreiten.
Behandlungseffekt
Wenn Sie vor der Entfernung des Tumors eine Krebsbehandlung (Chemotherapie oder Strahlentherapie oder beides) erhalten haben, wird Ihr Pathologe den Gewebebereich, in dem der Tumor zuvor identifiziert wurde, sorgfältig untersuchen, um festzustellen, ob noch Krebszellen am Leben (lebensfähig) sind. Das am häufigsten verwendete System beschreibt den Behandlungseffekt auf einer Skala von 0 bis 3, wobei 0 für keine lebensfähigen Krebszellen steht (alle Krebszellen sind tot) und 3 für ausgedehnten Restkrebs ohne erkennbare Rückbildung des Tumors steht (alle oder die meisten davon). die Krebszellen leben).
Tumorablagerung
Eine Tumorablagerung ist eine Gruppe von Krebszellen, die vom Haupttumor getrennt, aber nicht in einem Lymphknoten. Tumorablagerungen gehen mit einem erhöhten Risiko einher, dass sich die Tumorzellen nach der Behandlung in einen anderen Körperteil, beispielsweise in die Leber oder die Lunge, ausbreiten. Tumorablagerungen bestimmen auch das pathologische Tumorstadium (pT).
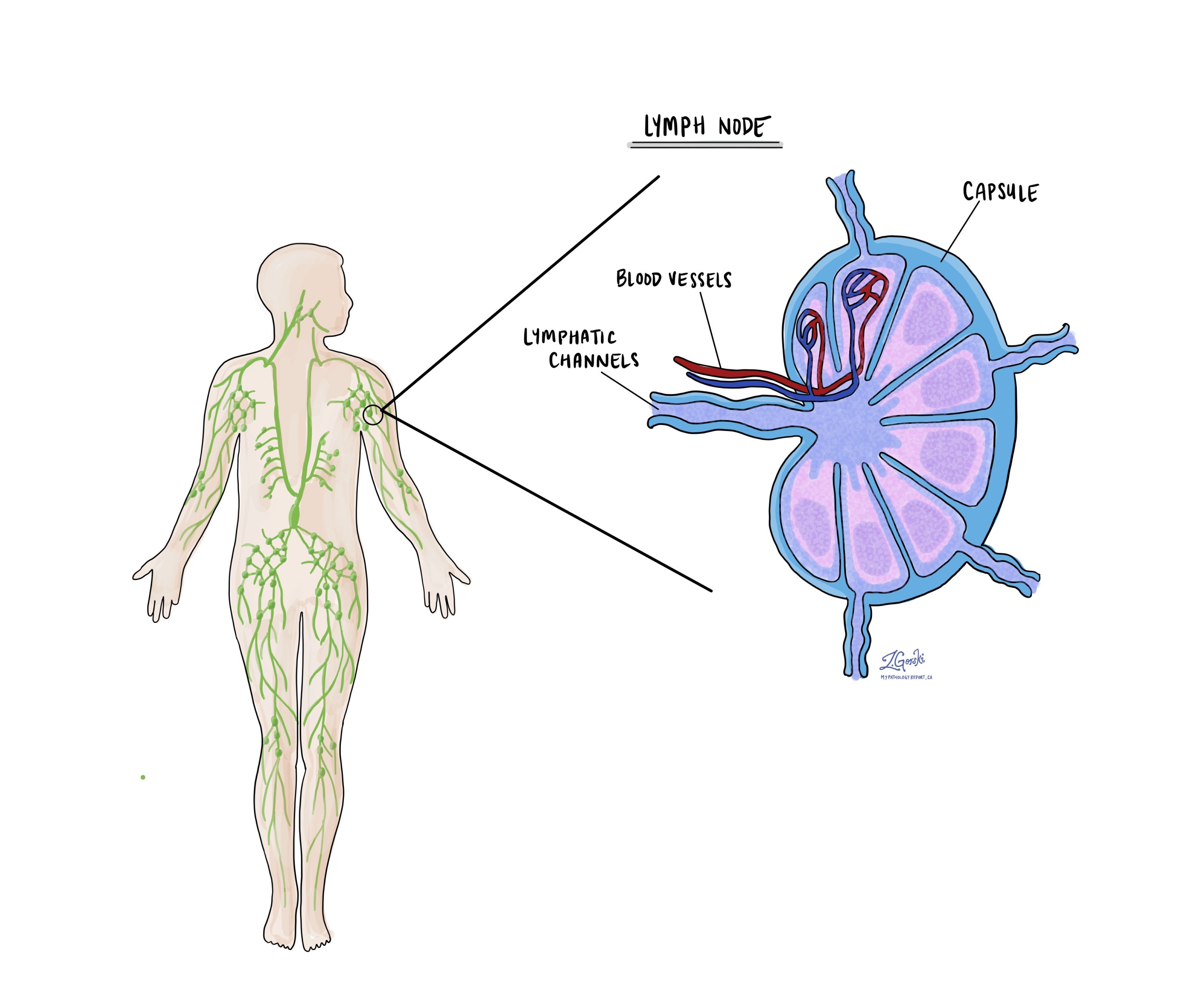
Lymphknoten
Kleine Immunorgane, bekannt als Lymphknoten, sind im ganzen Körper verteilt. Krebszellen können über winzige Lymphgefäße von einem Tumor zu diesen Lymphknoten wandern. Aus diesem Grund entfernen Ärzte häufig Lymphknoten und untersuchen sie mikroskopisch, um nach Krebszellen zu suchen. Dieser Prozess, bei dem Krebszellen vom ursprünglichen Tumor zu einem anderen Körperteil wie einem Lymphknoten wandern, wird als bezeichnet Metastasierung.
Krebszellen wandern in der Regel zunächst zu den Lymphknoten in der Nähe des Tumors, es können jedoch auch entfernte Lymphknoten betroffen sein. Daher entfernen Chirurgen typischerweise zuerst die Lymphknoten, die dem Tumor am nächsten liegen. Sie entfernen möglicherweise weiter vom Tumor entfernte Lymphknoten, wenn diese vergrößert sind und der starke Verdacht besteht, dass sie Krebszellen enthalten.
Pathologen untersuchen alle entfernten Lymphknoten unter einem Mikroskop und die Ergebnisse werden in Ihrem Bericht detailliert beschrieben. Ein „positives“ Ergebnis weist auf das Vorhandensein von Krebszellen im Lymphknoten hin, während ein „negatives“ Ergebnis bedeutet, dass keine Krebszellen gefunden wurden. Wenn der Bericht Krebszellen in einem Lymphknoten findet, kann er auch die Größe der größten Ansammlung dieser Zellen angeben, die oft als „Herd“ oder „Ablagerung“ bezeichnet wird. Extranodale Ausdehnung tritt auf, wenn Tumorzellen die äußere Kapsel des Lymphknotens durchdringen und sich in das angrenzende Gewebe ausbreiten.
Die Untersuchung der Lymphknoten ist aus zwei Gründen wichtig. Erstens hilft es bei der Bestimmung des pathologischen Knotenstadiums (pN). Zweitens deutet die Entdeckung von Krebszellen in einem Lymphknoten auf ein erhöhtes Risiko hin, später Krebszellen in anderen Körperteilen zu finden. Diese Informationen helfen Ihrem Arzt bei der Entscheidung, ob Sie zusätzliche Behandlungen wie Chemotherapie, Strahlentherapie oder Immuntherapie benötigen.
Mismatch-Reparaturproteine
Mismatch Repair (MMR) ist ein System in allen normalen, gesunden Zellen, das Fehler in unserem genetischen Material (DNA) behebt. Das System besteht aus verschiedenen Proteinen, und die vier häufigsten sind MSH2, MSH6, MLH1 und PMS2.
Die vier Mismatch-Reparaturproteine MSH2, MSH6, MLH1 und PMS2 arbeiten paarweise, um beschädigte DNA zu reparieren. Insbesondere funktioniert MSH2 mit MSH6 und MLH1 mit PMS2. Wenn ein Protein verloren geht, kann das Paar nicht normal funktionieren und das Risiko, an Krebs zu erkranken, steigt.
Wie testen Pathologen auf Mismatch-Reparaturproteine?
Die gebräuchlichste Methode zum Testen auf Mismatch-Reparaturproteine ist Immunhistochemie. Mit diesem Test können Pathologen feststellen, ob die Tumorzellen alle vier Mismatch-Reparaturproteine produzieren. Die Ergebnisse dieses Tests werden normalerweise wie folgt angegeben:
- Normales Ergebnis: Behaltene Proteinexpression.
- Abnormales Ergebnis: Verlust der Proteinexpression.
Warum ist das Testen auf Mismatch-Reparaturproteine wichtig?
Mismatch-Repair-Tests sind wichtig, da sie dabei helfen können, vorherzusagen, wie gut bestimmte Behandlungen wirken könnten. Beispielsweise ist es wahrscheinlicher, dass Krebserkrankungen mit einem Verlust der Expression von Mismatch-Reparaturproteinen auf Immuntherapien wie PD-1- oder PD-L1-Inhibitoren ansprechen. Dies liegt daran, dass die hohe Anzahl an Mutationen, die häufig in defizienten Tumoren vorkommen, neue Antigene produzieren kann, die den Tumor sichtbarer und anfälliger für das Immunsystem machen.
Mismatch-Repair-Tests werden auch durchgeführt, um Patienten zu identifizieren, die möglicherweise an einem Lynch-Syndrom leiden, das auch als erblicher nichtpolypöser kolorektaler Krebs (HNPCC) bekannt ist. Das Lynch-Syndrom ist eine genetische Störung, die das Risiko für die Entwicklung verschiedener Krebsarten erhöht, darunter Speiseröhrenkrebs, Dickdarmkrebs, Endometriumkrebs, Eierstockkrebs und Magenkrebs.
Weitere genetische Veränderungen, die beim invasiven Adenokarzinom des Dickdarms und des Mastdarms gefunden werden
- Mutationen im APC-Gen (Adenomatöse Polyposis Coli): Mutationen im APC-Gen kommen bei sporadischen Darmkrebsfällen fast allgegenwärtig vor und sind oft ein frühes Ereignis bei der Entwicklung von Darmkrebs. Das APC-Gen ist ein Tumorsuppressorgen und seine Inaktivierung führt zu abnormalem Zellwachstum.
- KRAS- und NRAS-Mutationen: Mutationen in den KRAS- und NRAS-Genen, Teil der RAS-Genfamilie, treten bei etwa 40–45 % der Darmkrebserkrankungen auf. Diese Mutationen führen zu unkontrollierter Zellteilung und unkontrolliertem Zellwachstum. Insbesondere das Vorhandensein von KRAS-Mutationen ist mit einer Resistenz gegen bestimmte Anti-EGFR-Therapien (epidermaler Wachstumsfaktorrezeptor) verbunden.
- BRAF-Mutationen: Die BRAF-Genmutation, insbesondere V600E, kommt bei etwa 10 % der Darmkrebserkrankungen vor. Sie ist oft mit einer schlechten Prognose und einer Resistenz gegenüber einigen Therapien verbunden. BRAF-Mutationen treten häufiger bei Krebsarten auf, die sich über den gezackten Weg entwickelt haben.
- PIK3CA-Mutationen: Mutationen im PIK3CA-Gen, das für eine Untereinheit der Phosphatidylinositol-3-Kinase (PI3K) kodiert, treten bei etwa 10–20 % der Darmkrebserkrankungen auf. Diese Mutationen können den AKT-Signalweg aktivieren und so die Zellproliferation und das Überleben fördern.
Tests zur Erkennung genetischer Veränderungen
- Next-Generation-Sequencing (NGS): NGS ermöglicht die gleichzeitige Untersuchung mehrerer Gene, um Mutationen, Deletionen und Amplifikationen zu erkennen. Dieser umfassende Ansatz kann alle häufigen genetischen Veränderungen bei Darmkrebs beurteilen, einschließlich APC-, KRAS-, NRAS-, BRAF- und PIK3CA-Mutationen.
- Polymerase-Kettenreaktion (PCR): Diese Technik amplifiziert DNA-Segmente und ermöglicht so die Analyse spezifischer genetischer Veränderungen wie KRAS-, NRAS- und BRAF-Mutationen.
- Fluoreszenz-in-situ-Hybridisierung (FISH): FISH kann genetische Anomalien wie Amplifikationen oder Deletionen innerhalb bestimmter Gene identifizieren. Es wird weniger häufig für die routinemäßige Erkennung der genannten genetischen Veränderungen verwendet, kann aber in bestimmten Kontexten hilfreich sein.
Über diesen Artikel
Ärzte haben diesen Artikel geschrieben, um Ihnen das Lesen und Verstehen Ihres Pathologieberichts zu erleichtern. Kontakt wenn Sie Fragen zu diesem Artikel oder Ihrem Pathologiebericht haben. Eine vollständige Einführung in Ihren Pathologiebericht finden Sie hier Dieser Artikel.