Джейсон Вассерман, доктор медицинских наук, доктор медицинских наук FRCPC, и Зузанна Горски, доктор медицинских наук
15 января 2024
Инвазивная аденокарцинома (также известная как аденокарцинома толстой кишки) является наиболее распространенным типом рака толстой кишки. Он состоит из клеток, которые обычно покрывают внутреннюю поверхность толстой кишки. Этот тип рака часто начинается с полипа, такого как тубулярная аденома, тубулярно-ворсинчатая аденомаили ворсинчатая аденома.
Эта статья поможет вам понять ваш диагноз и отчет о патологии инвазивной аденокарциномы толстой кишки.
Толстая кишка
Толстая кишка является частью пищеварительной системы и первой частью толстой кишки. Это длинная полая трубка, которая начинается в конце тонкой кишки и заканчивается прямой кишкой. Толстую кишку разделяют на четыре части: восходящую (правую), поперечную, нисходящую (левую) и сигмовидную. Он играет решающую роль в переработке отходов и поглощении воды, электролитов и некоторых витаминов. Инвазивная аденокарцинома может возникнуть в любом отделе толстой кишки.
Что вызывает инвазивную аденокарциному толстой кишки?
Считается, что инвазивная аденокарцинома толстой кишки вызвана сочетанием экологических и генетических факторов. Установленные факторы риска включают чрезмерное потребление обработанного мяса, красного мяса и алкоголя. Люди с избытком жира в организме также подвергаются повышенному риску развития этого типа рака. Продолжительный воспаление в толстой кишке, что наблюдается при воспалительных заболеваниях кишечника (язвенном колите и болезни Крона), также связано с повышенным риском развития инвазивной аденокарциномы.
Каковы симптомы инвазивной аденокарциномы толстой кишки?
Симптомы инвазивной аденокарциномы зависят от расположения опухоли в толстой кишке. Опухоли в левом отделе толстой кишки (нисходящей ободочной кишке) или прямой кишке могут вызывать изменения в работе кишечника, кровавый стул, боли в животе или вздутие живота. Опухоли в правой части толстой кишки (восходящей ободочной кишке) могут не вызывать никаких симптомов до тех пор, пока опухоль не станет очень большой или не распространится на другие части тела.
Где в толстой кишке начинается инвазивная аденокарцинома?
Инвазивная аденокарцинома толстой кишки возникает из-за эпителиальные клетки обычно находится на внутренней поверхности толстой кишки. Эти эпителиальные клетки соединяются, образуя структуры, называемые железы. Железы вместе с подлежащей собственной пластинкой и мышечной оболочкой образуют тонкий слой ткани, называемый слизистой оболочкой. Когда опухолевые клетки полностью располагаются внутри слизистой оболочки, это состояние называется дисплазия высокой степени.
Дисплазия высокой степени считается неинвазивным предраковым состоянием, и опухолевые клетки не могут метастазировать (распространение) на другие части тела. Однако по мере роста опухоли и проникновения клеток в нижележащие слои ткани диагноз меняется на инвазивную аденокарциному. В отличие от дисплазии высокой степени, опухолевые клетки при инвазивной карциноме могут метастазировать (распространяться) в лимфатический узел и другие части тела.

Микроскопические особенности этой опухоли
При микроскопическом исследовании инвазивная аденокарцинома толстой кишки состоит из групп аномальных клеток. эпителиальные клетки обычно располагаются неизменного размера железы (которые могут выглядеть как нормальные железы толстой кишки), гнезда или листки.
На что обратить внимание в отчете о патологии инвазивной аденокарциномы толстой кишки:
Муцинозная дифференциация
Патологи используют термин «муцинозная дифференцировка» для описания опухолей, содержащих большое количество внеклеточных клеток. муцин. Муцин представляет собой специализированный тип белка, вырабатываемый как нормальными, так и опухолевыми клетками. Внеклеточный означает, что муцин был виден вне опухолевых клеток. Если более 50% опухоли состоит из муцина, опухоль называется муцинозная аденокарцинома.
Гистологический класс
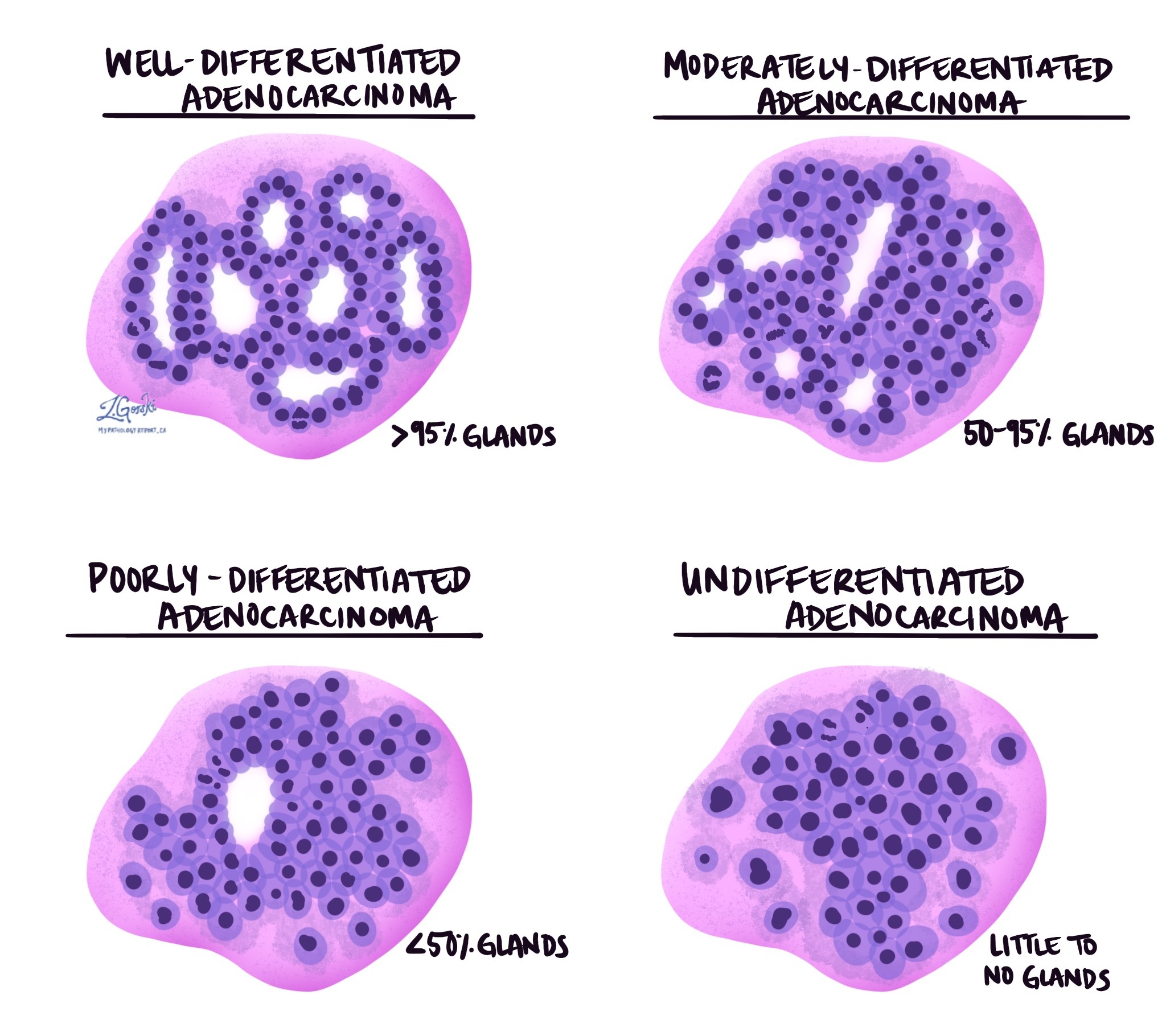
Инвазивная аденокарцинома толстой кишки разделяется на три степени – хорошо дифференцированную, умеренно дифференцированную и низкодифференцированную. Оценка основана на проценте опухолевых клеток, образующих круглые структуры, называемые железы. Опухоль, не образующая никаких желез, называется недифференцированной. Степень важна, поскольку низкодифференцированные и недифференцированные опухоли имеют тенденцию вести себя более агрессивно; например, эти опухоли с большей вероятностью распространяются на лимфатический узел и другие части тела.
- Хорошо дифференцированная: более 95% опухоли составляют железы. Патологи также описывают эти опухоли как 1-ю степень.
- Умеренно дифференцированная: от 50 до 95% опухоли составляют железы. Патологи также описывают эти опухоли как 2-ю степень.
- Плохо дифференцированная: менее 50% опухоли составляют железы. Патологи также описывают эти опухоли как 3-ю степень.
- Недифференцированный: в опухоли видно очень мало желез.
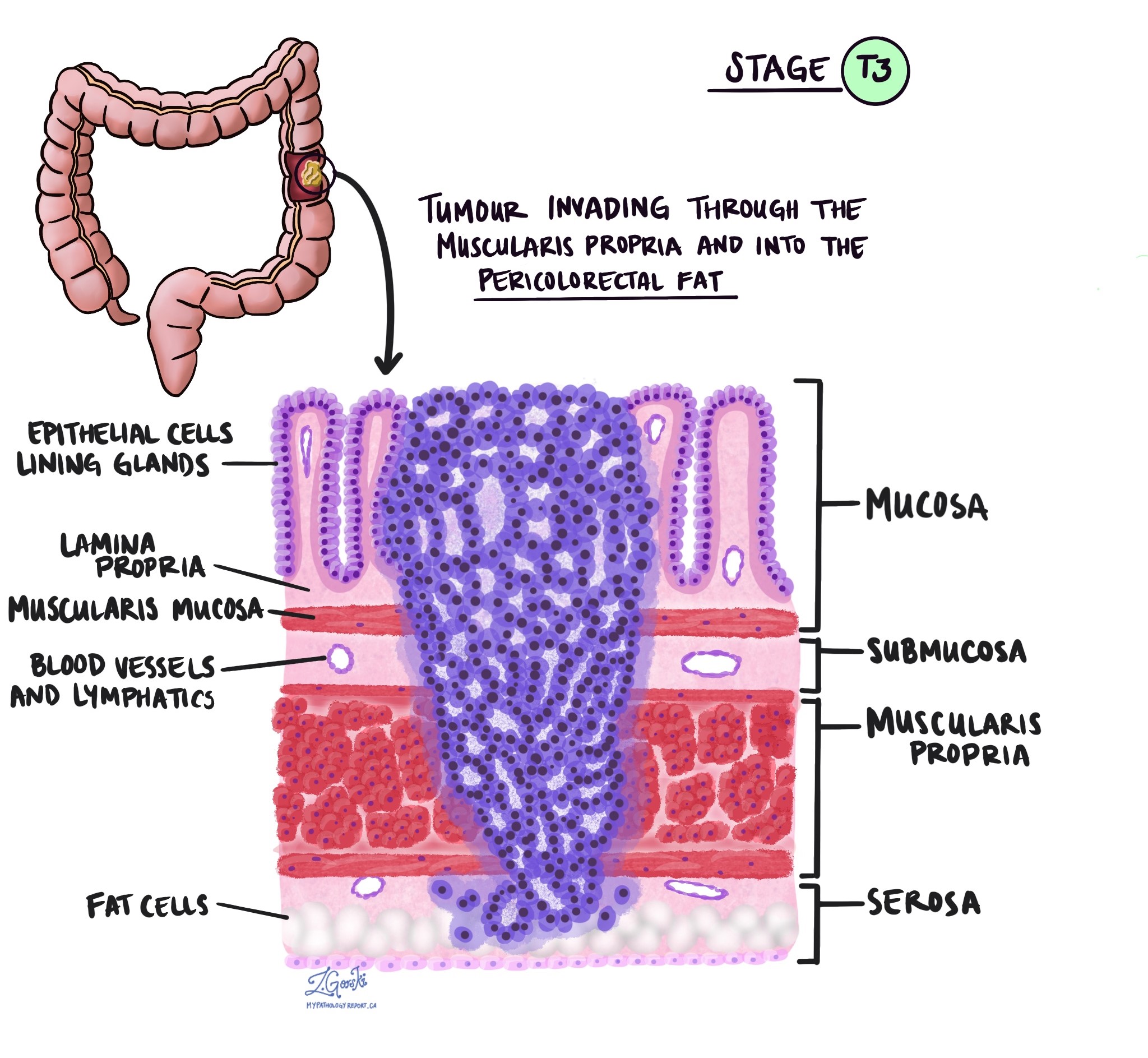
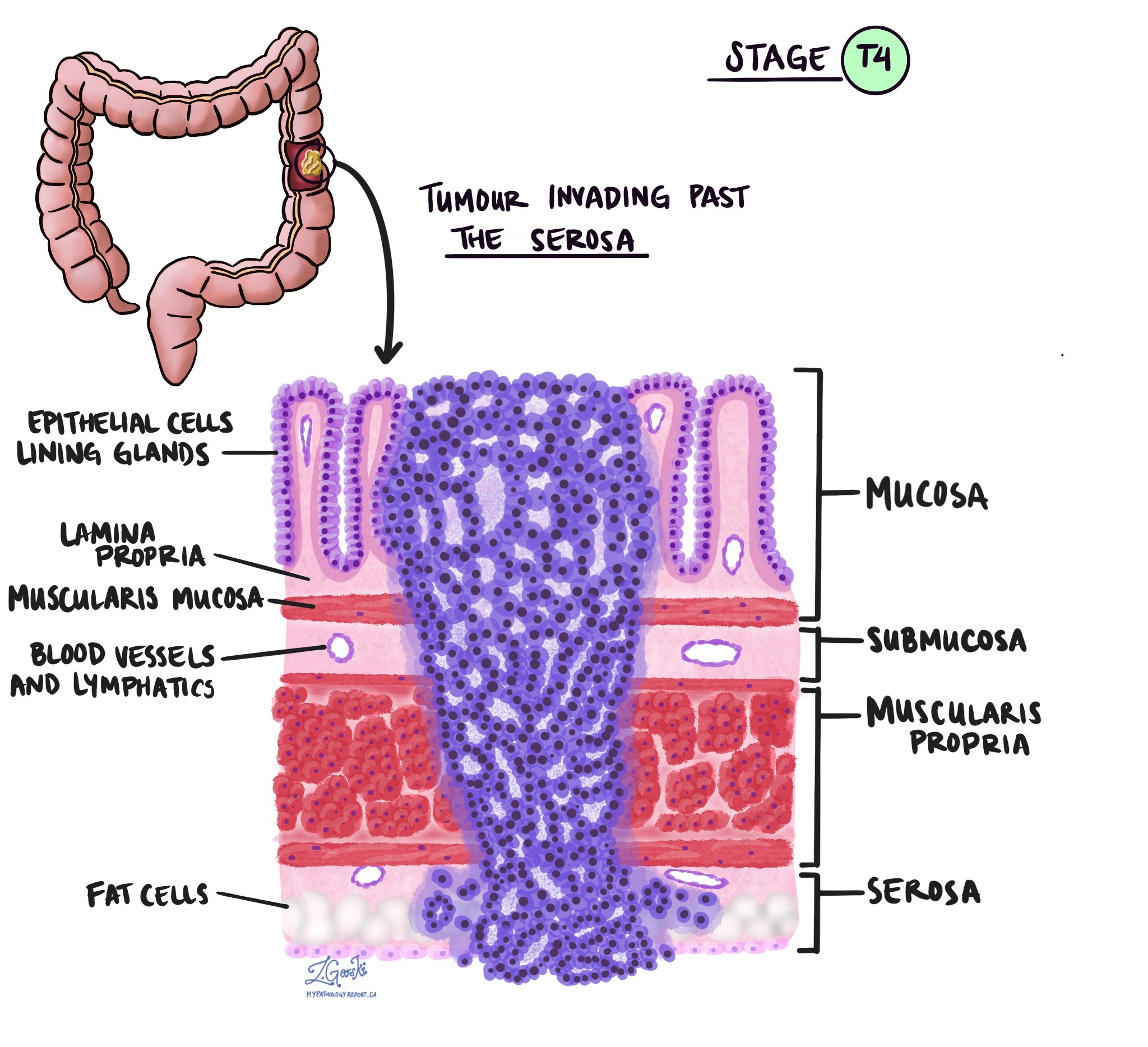
Глубина инвазии и патологическая стадия опухоли (pT)
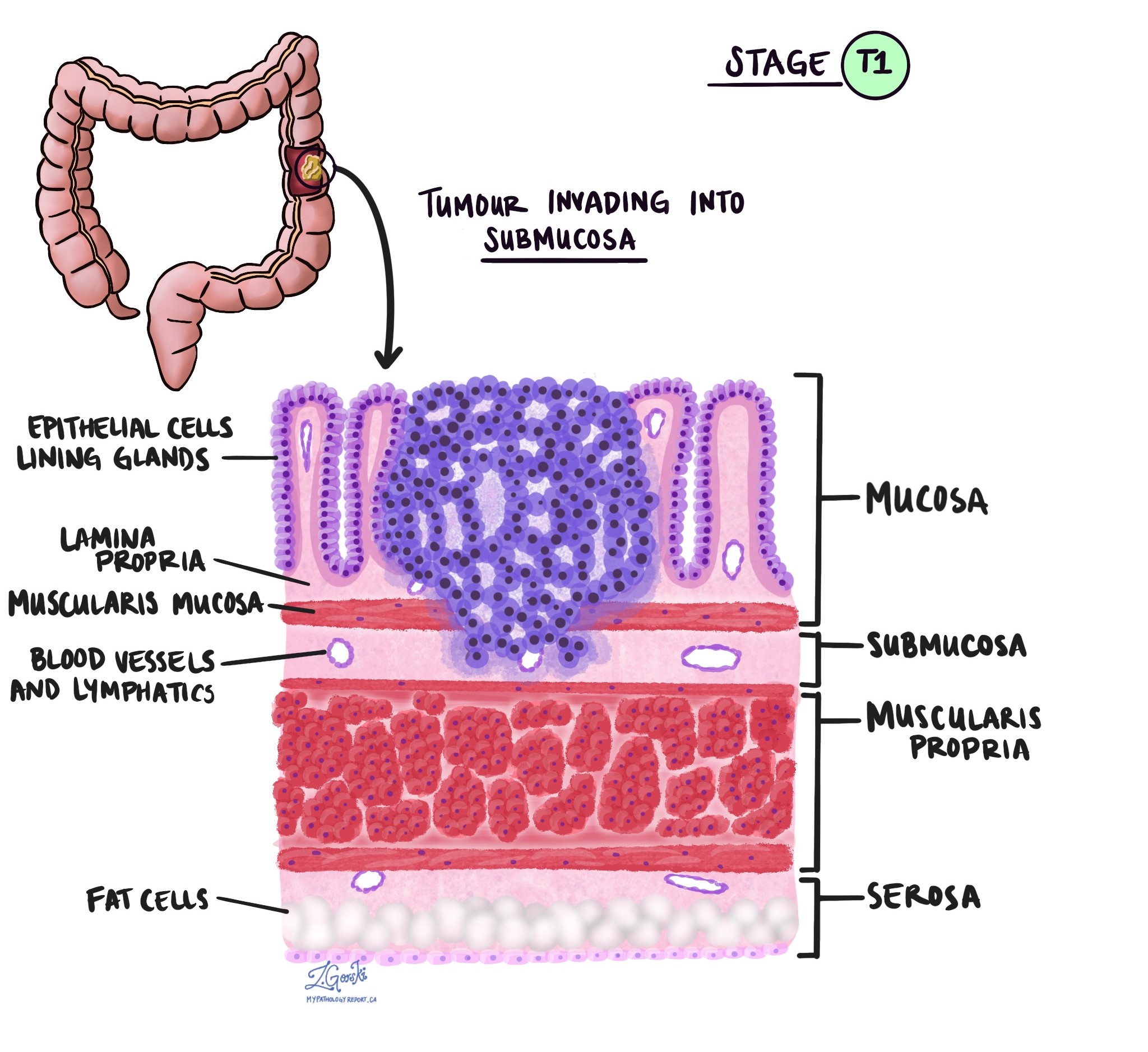
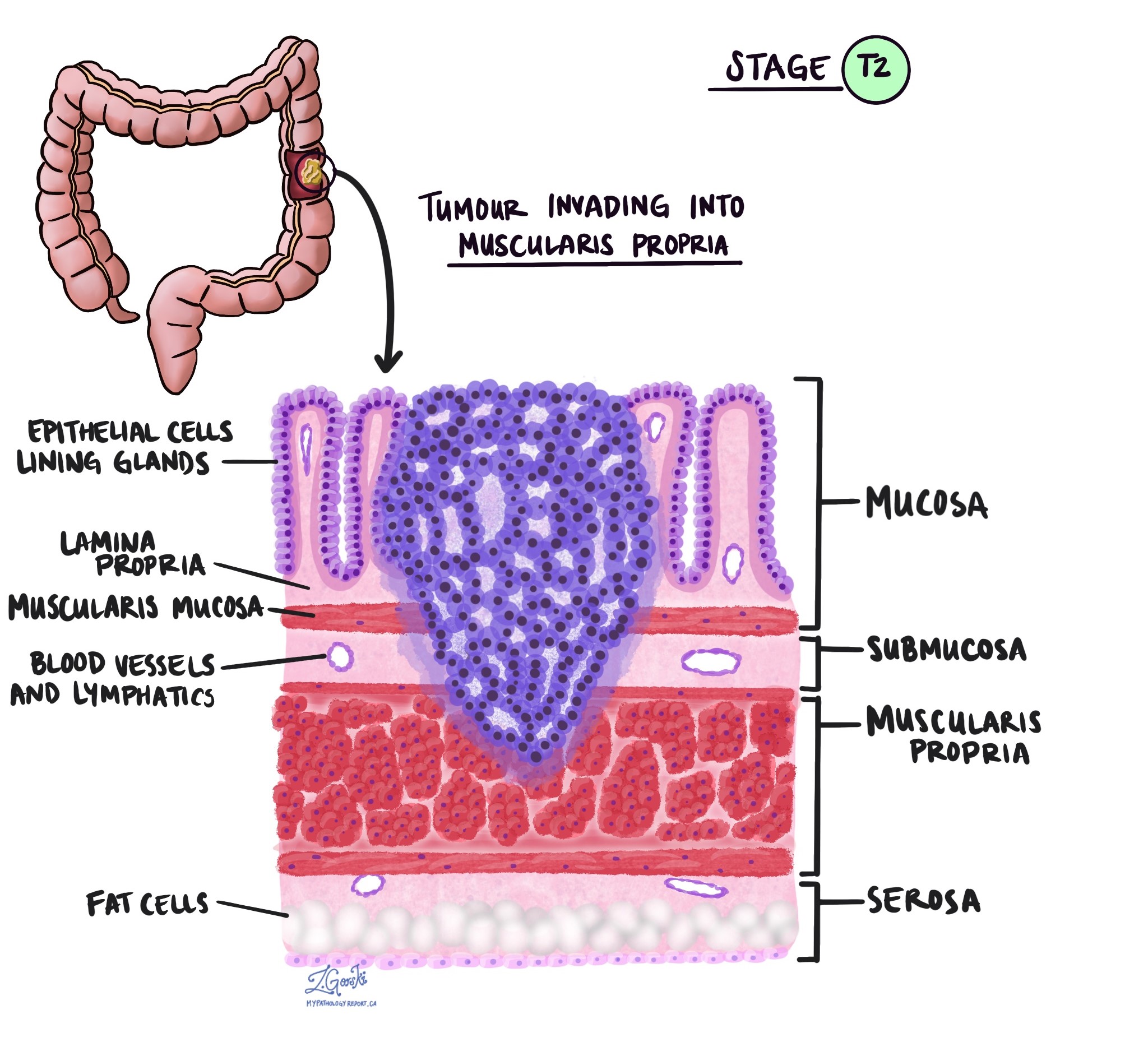
В патологии термин вторжение описывает распространение раковых клеток в органы или ткани, окружающие место, где возникла опухоль. Поскольку инвазивная аденокарцинома толстой кишки начинается в тонком слое ткани на внутренней поверхности толстой кишки, называемом слизистая оболочкаИнвазия определяется как распространение раковых клеток в другие слои тканей толстой кишки или любые другие органы за пределами толстой кишки. Инвазию можно увидеть только после того, как патологоанатом исследует опухоль под микроскопом.
При исследовании опухоли под микроскопом патологоанатом увидит, насколько далеко раковые клетки распространились из слизистой оболочки в окружающие ткани. Это называется глубиной или уровнем инвазии. Глубина инвазии важна, поскольку опухоли, проникающие глубже в стенку толстой кишки, с большей вероятностью распространяются на другие части тела, например лимфатический узел, печень или легкие. Уровень инвазии также используется для определения патологической стадии опухоли (pT). На изображениях ниже показана взаимосвязь между глубиной инвазии и стадией патологической опухоли.
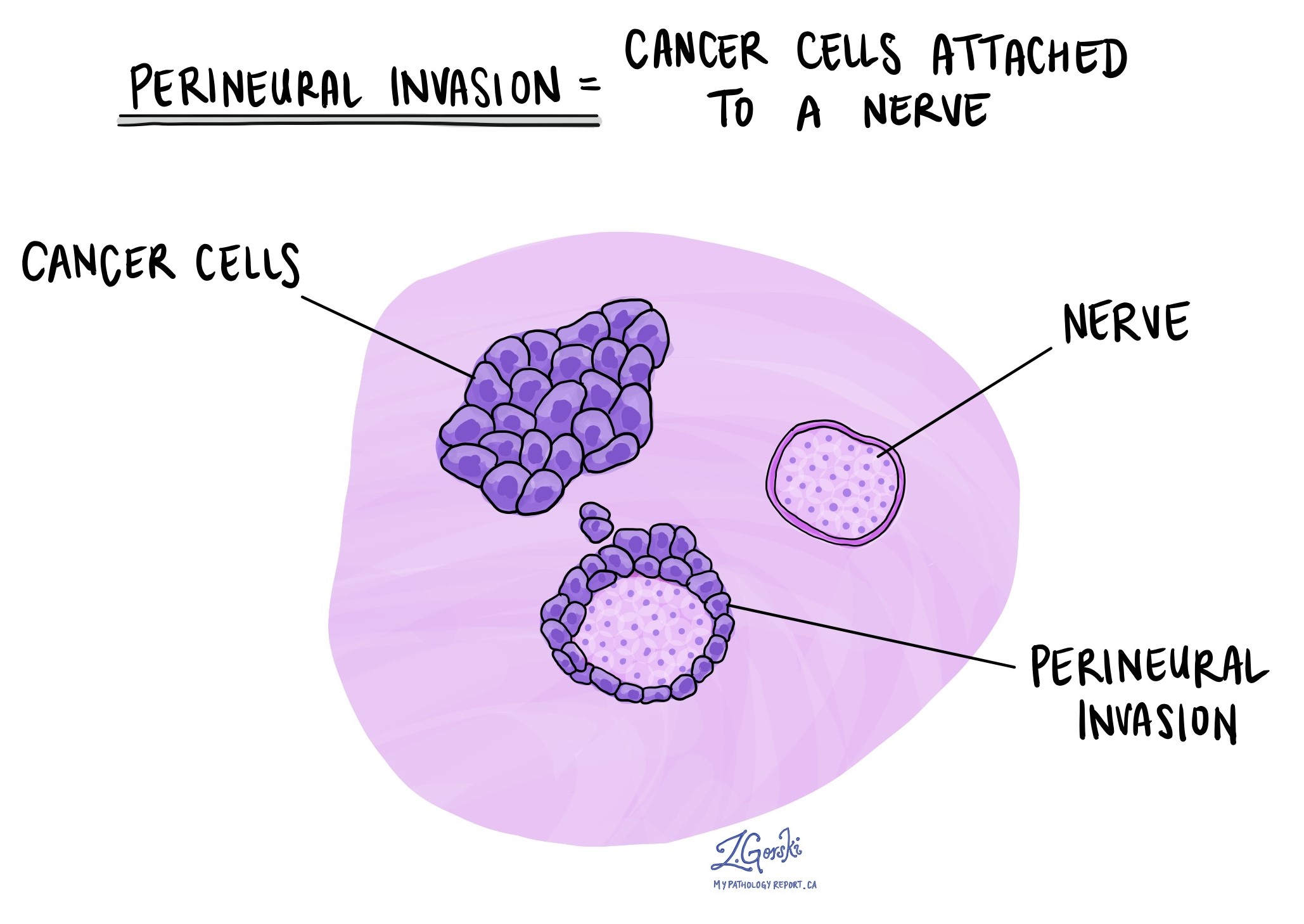
Периневральная инвазия
Патологи используют термин «периневральная инвазия» для описания ситуации, когда раковые клетки прикрепляются к нерву или вторгаются в него. «Внутриневральная инвазия» — это родственный термин, который конкретно относится к раковым клеткам, обнаруженным внутри нерва. Нервы, напоминающие длинные провода, состоят из групп клеток, известных как нейроны. Эти нервы, присутствующие по всему телу, передают такую информацию, как температура, давление и боль, между телом и мозгом. Наличие периневральной инвазии важно, поскольку она позволяет раковым клеткам перемещаться по нерву в близлежащие органы и ткани, повышая риск рецидива опухоли после операции.
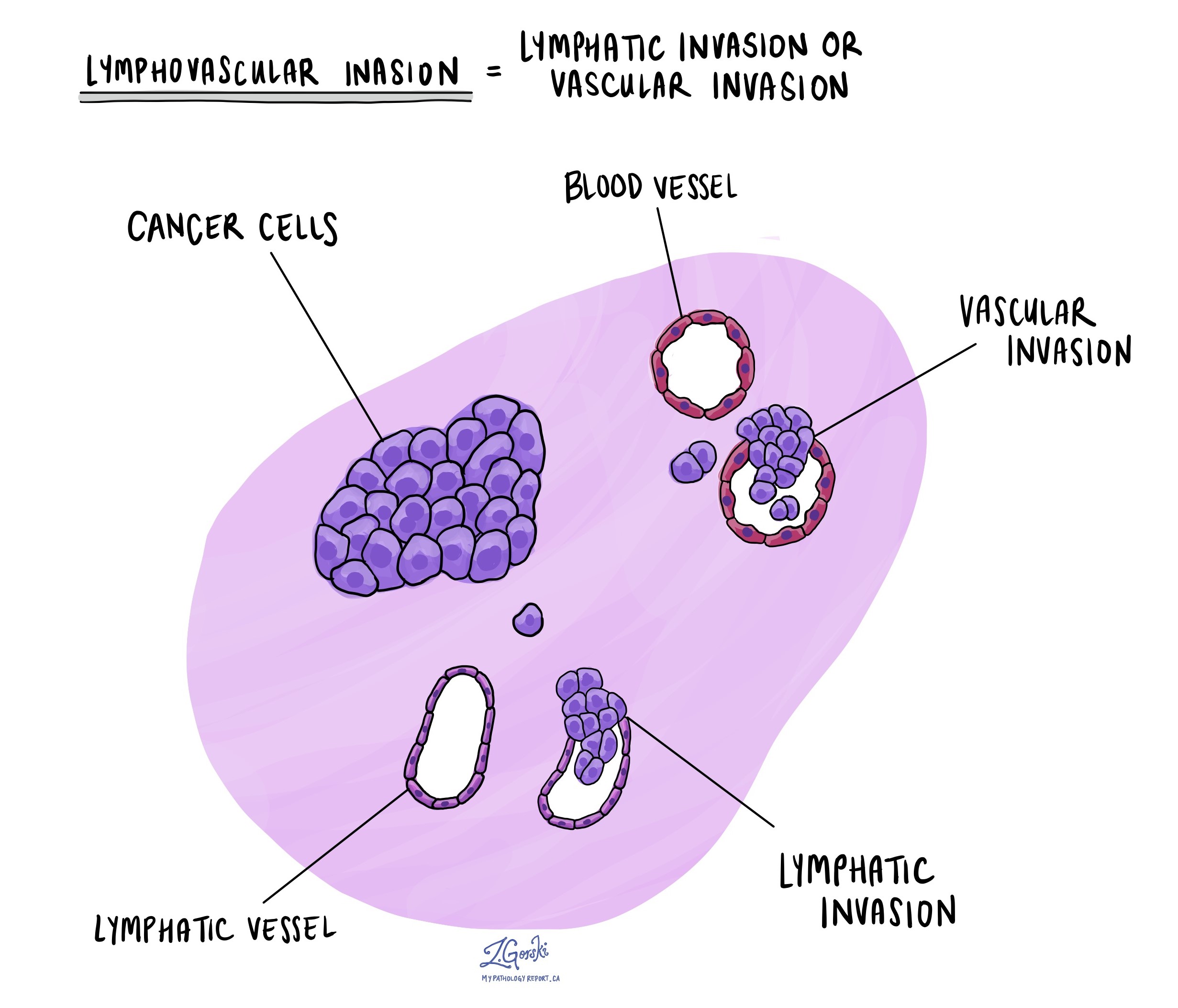
Лимфоваскулярная инвазия
Лимфоваскулярная инвазия возникает, когда раковые клетки проникают в кровеносный или лимфатический сосуд. Кровеносные сосуды представляют собой тонкие трубки, по которым кровь разносится по всему телу, тогда как лимфатические сосуды переносят жидкость, называемую лимфой, вместо крови. Эти лимфатические сосуды соединяются с небольшими иммунными органами, разбросанными по всему телу, известными как лимфатический узел.
Лимфоваскулярная инвазия важна, поскольку она позволяет раковым клеткам распространяться на другие части тела, включая лимфатические узлы или печень, через кровь или лимфатические сосуды. Кроме того, наличие раковых клеток внутри крупной вены за стенкой толстой кишки (за пределами толстого пучка мышц) связано с высоким риском того, что раковые клетки в конечном итоге будут обнаружены в печени.
Маржа
В патологии маргин – это край ткани, удаленной во время операции на опухоли. Статус полей в отчете о патологии важен, поскольку он указывает, была ли удалена вся опухоль или часть ее осталась. Эта информация помогает определить необходимость дальнейшего лечения.
Патологи обычно оценивают границы после хирургической процедуры, например иссечение or резекция, направленный на удаление всей опухоли. Маржа обычно не оценивается после биопсия, при котором удаляется только часть опухоли. Количество указанных границ и их размер (сколько нормальной ткани находится между опухолью и краем среза) варьируются в зависимости от типа ткани и местоположения опухоли.
Патологи исследуют края, чтобы проверить, присутствуют ли опухолевые клетки на краю среза ткани. Положительный предел при обнаружении опухолевых клеток предполагает, что часть рака может остаться в организме. Напротив, отрицательный край без опухолевых клеток по краю предполагает, что опухоль была полностью удалена. В некоторых отчетах также измеряется расстояние между ближайшими опухолевыми клетками и границей, даже если все границы отрицательны.

Почкование опухоли
Почкование опухоли — это термин, который патологоанатомы используют для описания отдельных раковых клеток или небольших групп раковых клеток, видимых на краю опухоли. Считается, что это признак того, что опухоль становится менее дифференцированной. В зависимости от количества бутонов, видимых под микроскопом, присваивается оценка: низкая, средняя или высокая. Высокий балл связан с повышенным риском распространения раковых клеток на другую часть тела.
Эффект лечения
Если вы проходили лечение рака (химиотерапию, лучевую терапию или и то, и другое) до удаления опухоли, ваш патологоанатом тщательно исследует участок ткани, где ранее была обнаружена опухоль, чтобы проверить, живы ли (жизнеспособны) какие-либо раковые клетки. Наиболее часто используемая система описывает эффект лечения по шкале от 0 до 3, где 0 означает отсутствие жизнеспособных раковых клеток (все раковые клетки мертвы), а 3 означает обширный остаточный рак без видимой регрессии опухоли (все или большая часть раковых клеток). раковые клетки живы).
Опухолевый депозит
Отложение опухоли - это группа раковых клеток, которые отделены от основной опухоли, но не в лимфатический узел. Опухолевые отложения связаны с более высоким риском распространения опухолевых клеток в другую часть тела, например, в печень или легкие, после лечения. Опухолевые отложения также определяют патологическую стадию опухоли (pT).
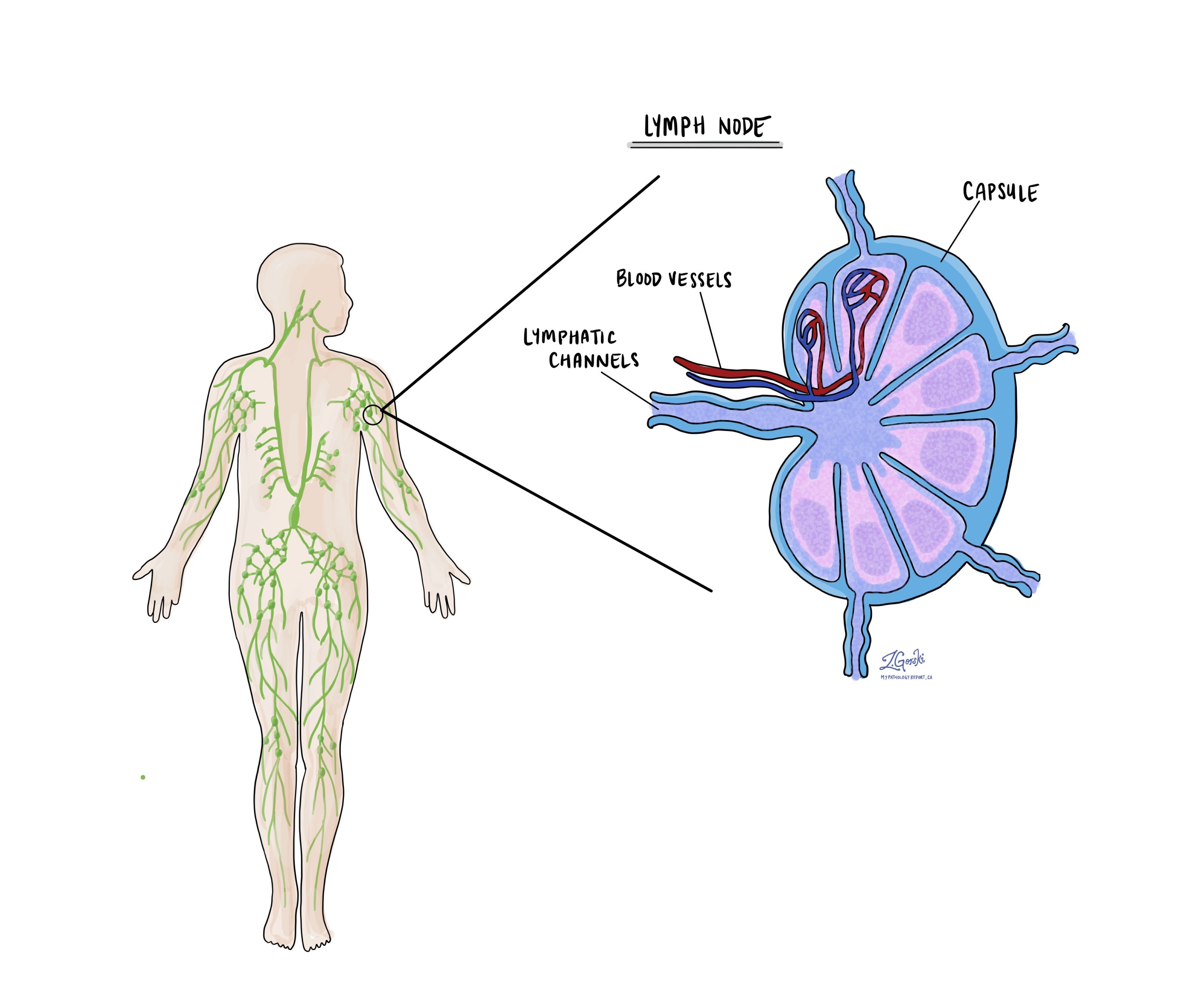
Лимфатические узлы
Малые иммунные органы, известные как лимфатический узел, расположены по всему телу. Раковые клетки могут перемещаться из опухоли в эти лимфатические узлы через крошечные лимфатические сосуды. По этой причине врачи часто удаляют и микроскопируют лимфатические узлы на наличие раковых клеток. Этот процесс, при котором раковые клетки перемещаются из исходной опухоли в другую часть тела, например, в лимфатический узел, называется метастазирование.
Раковые клетки обычно сначала мигрируют в лимфатические узлы рядом с опухолью, хотя могут поражаться и отдаленные лимфатические узлы. Следовательно, хирурги обычно сначала удаляют ближайшие к опухоли лимфатические узлы. Они могут удалить лимфатические узлы, расположенные дальше от опухоли, если они увеличены и есть серьезное подозрение, что они содержат раковые клетки.
Патологоанатомы исследуют любые удаленные лимфатические узлы под микроскопом, и результаты будут подробно описаны в вашем отчете. «Положительный» результат указывает на наличие раковых клеток в лимфатическом узле, а «отрицательный» результат означает, что раковые клетки не обнаружены. Если в отчете обнаруживаются раковые клетки в лимфатическом узле, в нем также может быть указан размер самого большого скопления этих клеток, часто называемого «очагом» или «депозитом». Экстранодальное распространение происходит, когда опухолевые клетки проникают во внешнюю капсулу лимфатического узла и распространяются в прилегающие ткани.
Исследование лимфатических узлов важно по двум причинам. Во-первых, это помогает определить патологическую узловую стадию (pN). Во-вторых, обнаружение раковых клеток в лимфатическом узле предполагает повышенный риск обнаружения раковых клеток в других частях тела позже. Эта информация поможет вашему врачу решить, нужны ли вам дополнительные методы лечения, такие как химиотерапия, лучевая терапия или иммунотерапия.
Белки репарации несоответствия
Восстановление несоответствия (MMR) — это система внутри всех нормальных, здоровых клеток, которая исправляет ошибки в нашем генетическом материале (ДНК). Система состоит из различных белков, наиболее распространенными из которых являются MSH2, MSH6, MLH1 и PMS2.
Четыре белка восстановления несоответствий MSH2, MSH6, MLH1 и PMS2 работают парами, восстанавливая поврежденную ДНК. В частности, MSH2 работает с MSH6, а MLH1 — с PMS2. Если один белок потерян, пара не может нормально функционировать, и риск развития рака увеличивается.
Как патологи проверяют белки восстановления несоответствия?
Самый распространенный способ проверить наличие белков репарации несоответствий — это иммуногистохимия. Этот тест позволяет патологам увидеть, производят ли опухолевые клетки все четыре белка восстановления несоответствий. Результаты этого теста обычно сообщаются следующим образом:
- Нормальный результат: экспрессия белка сохранена.
- Аномальный результат: потеря экспрессии белка.
Почему так важно тестирование белков репарации несоответствия?
Тестирование на восстановление несоответствия важно, поскольку оно может помочь предсказать, насколько хорошо могут работать определенные методы лечения. Например, рак с потерей экспрессии белка восстановления несоответствия с большей вероятностью будет реагировать на иммунотерапевтическое лечение, такое как ингибиторы PD-1 или PD-L1. Это связано с тем, что большое количество мутаций, часто встречающихся в дефектных опухолях, может производить новые антигены, которые делают опухоль более заметной и уязвимой для иммунной системы.
Тест на восстановление несоответствия также проводится для выявления пациентов, у которых может быть синдром Линча, также известный как наследственный неполипозный колоректальный рак (HNPCC). Синдром Линча — генетическое заболевание, которое увеличивает риск развития различных типов рака, включая рак пищевода, рак толстой кишки, рак эндометрия, рак яичников и рак желудка.
Другие генетические изменения, обнаруженные при инвазивной аденокарциноме толстой и прямой кишки
- Мутации гена APC (аденоматозного полипоза Coli): практически повсеместно встречающиеся в спорадических случаях рака толстой кишки мутации гена APC часто являются ранним событием в развитии колоректального рака. Ген APC является геном-супрессором опухолей, и его инактивация приводит к аномальному росту клеток.
- Мутации KRAS и NRAS. Мутации в генах KRAS и NRAS, входящих в семейство генов RAS, встречаются примерно в 40–45% случаев колоректального рака. Эти мутации приводят к неконтролируемому делению и росту клеток. Наличие мутаций KRAS, в частности, связано с устойчивостью к определенным методам лечения анти-EGFR (рецептор эпидермального фактора роста).
- Мутации BRAF. Мутация гена BRAF, особенно V600E, обнаруживается примерно в 10% случаев колоректального рака. Это часто связано с плохим прогнозом и устойчивостью к некоторым методам лечения. Мутации BRAF чаще встречаются при раке, развившемся по зубчатому пути.
- Мутации PIK3CA. Мутации гена PIK3CA, который кодирует субъединицу фосфатидилинозитол-3-киназы (PI3K), встречаются примерно в 10–20% случаев колоректального рака. Эти мутации могут активировать сигнальный путь АКТ, способствуя пролиферации и выживанию клеток.
Тесты, используемые для выявления генетических изменений
- Секвенирование нового поколения (NGS): NGS позволяет одновременно исследовать несколько генов для выявления мутаций, делеций и амплификаций. Этот комплексный подход позволяет оценить все распространенные генетические изменения при колоректальном раке, включая мутации APC, KRAS, NRAS, BRAF и PIK3CA.
- Полимеразная цепная реакция (ПЦР). Этот метод амплифицирует сегменты ДНК, позволяя анализировать определенные генетические изменения, такие как мутации KRAS, NRAS и BRAF.
- Флуоресцентная гибридизация in situ (FISH): FISH может выявлять генетические аномалии, такие как амплификации или делеции в определенных генах. Он реже используется для рутинного обнаружения упомянутых генетических изменений, но может быть полезен в определенных контекстах.
Об этой статье
Врачи написали эту статью, чтобы помочь вам прочитать и понять отчет о патологии. Свяжитесь с нами если у вас есть вопросы по поводу этой статьи или отчета о патологии. Полную информацию об отчете о патологии см. этой статье.