بواسطة جايسون واسرمان دكتوراه في الطب دكتوراه FRCPC
21 كانون الأول، 2023
سرطان المعدة الغدي، المعروف أيضًا باسم سرطان المعدة، هو نوع من السرطان يبدأ من الخلايا التي تغطي السطح الداخلي للمعدة. وهو الشكل الأكثر شيوعًا لسرطان المعدة، حيث يمثل حوالي 90٪ إلى 95٪ من جميع سرطانات المعدة. ال المراجع يختلف سرطان المعدة الغدي بشكل كبير اعتمادًا على الدرجة النسيجية والمرحلة في وقت التشخيص وانتشار الخلايا السرطانية إلى الغدد الليمفاوية.
ستساعدك هذه المقالة على فهم تشخيصك وتقريرك المرضي عن سرطان المعدة الغدي.
المعدة
المعدة هي عضو عضلي مجوف في الجهاز الهضمي للإنسان والعديد من الحيوانات. إنه يلعب دورًا حاسمًا في الجهاز الهضمي عن طريق معالجة الطعام المبتلع، وتقسيمه إلى شكل شبه سائل يسمى الكيموس، وإطلاقه تدريجيًا في الأمعاء الدقيقة.
تنقسم المعدة إلى أربعة أقسام رئيسية، لكل منها وظائف محددة:
- الفؤاد: هذا هو القسم الأول الذي يدخل فيه الطعام إلى المعدة من المريء. يحتوي على غدد تفرز المخاط، مما يحمي بطانة المعدة من العصارة المعدية الحمضية.
- قاع العين: يقع فوق الفؤاد، ويقوم بتخزين الطعام غير المهضوم والغازات المنطلقة من الهضم الكيميائي للطعام. يلعب دورًا ثانويًا في عملية الهضم.
- الجسم (الجسم): القسم الأكبر والجزء الهضمي الرئيسي للمعدة، يفرز الجسم الحمض والإنزيمات الهاضمة لتكسير الطعام كيميائيًا إلى شكل شبه سائل، الكيموس.
- البواب: القسم الأخير من المعدة الذي يعمل كصمام للتحكم في إفراغ محتويات المعدة إلى الأمعاء الدقيقة. يحتوي على العضلة العاصرة البوابية، التي تفتح للسماح للكيم بالمرور إلى الأمعاء الدقيقة وتغلق لمنع التدفق العكسي.
الغار هو الموقع الأكثر شيوعًا لسرطان المعدة الغازي. هذه المنطقة معرضة بشكل خاص للإصابة بالسرطان الغدي بسبب تعرضها لعوامل مختلفة يمكن أن تساهم في تطور السرطان، مثل هيليكوباكتر بيلوري عدوى، التهاب مزمنوالعوامل الغذائية ووجود الأحماض الصفراوية.
ما الذي يسبب سرطان غدي في المعدة؟
تشمل العوامل البيئية المرتبطة بالسرطان الغدي في المعدة هيليكوباكتر بيلوري عدوى، فيروس ابشتاين بار (EBV) العدوى وتدخين التبغ والعوامل الغذائية. ترتبط الطفرات الجينية التي تتضمن الجينات CDH1 أو APC أيضًا بزيادة خطر الإصابة بسرطان غدي في المعدة.
ما هي أعراض سرطان المعدة الغدي؟
قد تشمل أعراض سرطان المعدة الغدي صعوبة في البلع، وفقدان الوزن، وآلام في المعدة، والغثيان، والقيء، والشعور بالشبع بعد تناول كميات صغيرة من الطعام. ومع ذلك، فإن المراحل المبكرة من المرض غالبًا ما تنتج أعراضًا قليلة أو معدومة، مما يجعل الكشف المبكر أمرًا صعبًا.
ما الذي يجب أن تبحث عنه في تقريرك المرضي عن سرطان المعدة الغدي:
الصف النسيجي
ينقسم سرطان المعدة الغدي الغازي إلى ثلاث درجات – متباينة جيدًا، ومتباينة إلى حد ما، وسيئة التمايز. يعتمد التصنيف على النسبة المئوية للخلايا السرطانية التي تشكل هياكل مستديرة تسمى الغدد. يسمى الورم الذي لا يشكل أي غدد غير متمايز. الدرجة مهمة لأن الأورام سيئة التمايز وغير المتمايزة تميل إلى التصرف بشكل أكثر عدوانية؛ على سبيل المثال، من المرجح أن تنتشر هذه الأورام إلى الغدد الليمفاوية وأجزاء أخرى من الجسم.
- متباين بشكل جيد: أكثر من 95% من الورم يتكون من غدد. ويصف علماء الأمراض أيضًا هذه الأورام بأنها من الدرجة الأولى.
- متباين إلى حد ما: 50 إلى 95٪ من الورم يتكون من غدد. يصف علماء الأمراض أيضًا هذه الأورام بأنها من الدرجة الثانية.
- تمايز ضعيف: أقل من 50% من الورم يتكون من غدد. يصف علماء الأمراض أيضًا هذه الأورام بأنها من الدرجة الثالثة.
- غير متمايزة: يتم رؤية عدد قليل جدًا من الغدد في أي مكان من الورم.
سرطان غدي من النوع المنتشر في المعدة
السرطان الغدي المنتشر في المعدة هو نوع فرعي نسيجي محدد يتميز بانتشار الخلايا السرطانية على نطاق واسع في جميع أنحاء بطانة المعدة دون تشكيل كتلة مميزة. هذا التصنيف هو جزء من نظام تصنيف لورين، الذي يقسم سرطان المعدة الغدي إلى أنواع معوية ومنتشرة. الاسم البديل للسرطان الغدي المنتشر هو سرطان غدي ضعيف التماسك.
يتميز سرطان المعدة المنتشر بتوزيع الخلايا السرطانية بشكل متناثر عبر جدار المعدة، بما في ذلك في كثير من الأحيان خلايا حلقة الخاتموالتي تتميز بمظهرها المميز بسبب وجود فجوة كبيرة تعمل على إزاحة نواة الخلية. هذا النوع الفرعي أقل ارتباطًا بالعوامل البيئية وأكثر ارتباطًا بالاستعداد الوراثي، مما قد يؤثر على المرضى الأصغر سنًا ويظهر نمطًا عائليًا.
يشكل السرطان الغدي المنتشر في المعدة تحديات كبيرة من حيث التشخيص والعلاج. نظرًا لطبيعته المنتشرة على نطاق واسع وعدم وجود كتلة ورم محددة جيدًا، فقد يكون من الصعب اكتشافه مبكرًا. ويعتبر بشكل عام أكثر عدوانية من النوع المعوي، مع ميل إلى حدوث ورم خبيث مبكر واستجابة أقل للعلاج الكيميائي التقليدي. وبالتالي، غالبًا ما يكون تشخيص سرطان المعدة المنتشر أسوأ، مما يؤكد أهمية تحديد هذا النوع الفرعي مبكرًا لتصميم استراتيجيات العلاج الأكثر فعالية.
سرطان غدي من النوع السيئ التماسك في المعدة
سرطان المعدة الغدي ضعيف التماسك هو نوع فرعي نسيجي محدد يتميز بخلايا سرطانية لا تلتصق ببعضها البعض أو تشكل أورامًا صلبة، وبدلاً من ذلك تنتشر في جميع أنحاء بطانة المعدة وجدارها. هذه الخاصية تجعل من الصعب اكتشاف السرطان وتشخيصه مبكرًا نظرًا لأن عدم وجود كتلة محددة يعني أنه قد لا يمكن التعرف عليه بسهولة من خلال التصوير أو التنظير. الاسم البديل للسرطان الغدي ضعيف التماسك هو السرطان الغدي المنتشر.
يتميز النوع ضعيف التماسك من السرطان الغدي بتوزيع الخلايا السرطانية بشكل متناثر عبر جدار المعدة، بما في ذلك في كثير من الأحيان. خلايا حلقة الخاتم. تُعرف هذه الخلايا بمظهرها المميز بسبب وجود فجوة كبيرة تحل محل نواة الخلية.
يعد تحديد النوع الفرعي ضعيف التماسك أمرًا بالغ الأهمية لتخطيط العلاج والتشخيص. ونظرًا لأن هذه الخلايا السرطانية تنتشر على نطاق واسع وتفتقر إلى الاتصالات بين الخلايا، فيمكنها اختراق جدار المعدة بشكل أعمق ينتشر كالسرطان إلى أعضاء أخرى في وقت أبكر من أشكال السرطان الأكثر تماسكًا. يساهم هذا السلوك في سيناريو علاج أكثر تحديًا ويشير بشكل عام إلى تشخيص أسوأ. يتيح التعرف على هذا النوع الفرعي للأطباء التفكير في أساليب علاجية أكثر عدوانية ومصممة خصيصًا، مع الاعتراف بالتحديات الفريدة في إدارة هذا النوع من سرطان المعدة.
خلايا حلقة الخاتم
خلايا حلقة الخاتم توجد عادة في سرطان المعدة المنتشر أو ضعيف التماسك. تحتوي هذه الخلايا على فجوات كبيرة من الميوسين التي تدفع النواة إلى المحيط، مما يعطي الخلية مظهرًا يشبه الحلقة. هذه الميزة مهمة لأن سرطان الخلايا الحلقية الخاتم معروف بسلوكه العدواني وميله إلى الانتشار بشكل أكثر انتشارًا في جميع أنحاء جدار المعدة وخارجه، مقارنة بالأشكال الأخرى من سرطان المعدة. عادةً ما تُرى الخلايا الحلقية ذات الخاتم في سرطان غدي من النوع ضعيف التماسك وسرطان غدي من النوع المنتشر في المعدة.
يعد تحديد خلايا حلقة الخاتم أمرًا مهمًا لعدة أسباب. أولا، غالبا ما يشير إلى تشخيص أسوأ بسبب الطبيعة العدوانية للسرطان وقدرته على الانتشار بسرعة. ثانيًا، يمكن أن تؤثر هذه النتيجة على قرارات العلاج، حيث أن السرطانات التي تحتوي على خلايا الخاتم قد تستجيب بشكل مختلف للعلاج الكيميائي والعلاجات الأخرى مقارنة بالأنواع الأخرى من سرطان المعدة.
عمق الغزو والمرحلة المرضية (pT)
في علم الأمراض "غزو"يشير إلى العملية التي تنتشر فيها الخلايا السرطانية من الموقع الأصلي للورم إلى الأنسجة أو الأعضاء المحيطة. على وجه التحديد، في حالة السرطان الغدي، الذي ينشأ في المعدة الغشاء المخاطي (البطانة الداخلية)، يعني الغزو أن الخلايا السرطانية انتقلت إلى طبقات أخرى من المعدة أو حتى إلى أعضاء خارج المعدة. لا يستطيع أخصائي علم الأمراض ملاحظة الغزو إلا من خلال فحص الورم تحت المجهر.
خلال هذا الفحص المجهري، يحدد أخصائي علم الأمراض مدى انتقال الخلايا السرطانية خارج الغشاء المخاطي إلى الأنسجة القريبة، والمعروفة باسم عمق أو مستوى الغزو. تكمن أهمية تحديد عمق الغزو في قدرته على التنبؤ بعدوانية السرطان: فالأورام التي تخترق عمقًا أكبر في جدار المعدة تكون أكثر عرضة للانتشار إلى أجزاء أخرى من الجسم، بما في ذلك الغدد الليمفاويةأو الكبد أو الرئتين. علاوة على ذلك، فإن عمق الغزو يساعد في تحديد المرحلة المرضية للورم (pT)، وهو أمر بالغ الأهمية لاتخاذ قرار بشأن استراتيجية العلاج الأكثر ملاءمة.
تصف معظم تقارير علم الأمراض الخاصة بسرطان المعدة الغازي عمق أو مستوى الغزو على النحو التالي:
- العضلي: ويسمى الورم داخل الغشاء المخاطي إذا لم تنتشر الخلايا السرطانية خارج الغشاء المخاطي. يشمل الغشاء المخاطي الصفيحة المخصوصة أو الغشاء المخاطي العضلي.
- تحت المخاطية: تحت المخاطية يعني أن الخلايا السرطانية قد اجتازت الغشاء المخاطي العضلي ودخلت إلى الطبقة تحت المخاطية.
- العضلية المخصوصة: العضلة المخصوصة هي حزمة سميكة من العضلات في منتصف المعدة. عادة لا يمكن رؤية هذا المستوى من الغزو إلا بعد إزالة الورم بأكمله.
- الأنسجة الرخوة تحت المصلية: توجد الخلايا السرطانية في الأنسجة الرخوة تحت المصلية بالقرب من السطح الخارجي للمعدة.
- مصلي: الخلايا السرطانية التي تمر عبر المصل على السطح الخارجي للمعدة. من هنا، يمكن أن تنتشر الخلايا السرطانية إلى الأعضاء المجاورة مثل الطحال أو البنكرياس أو الأمعاء الدقيقة أو القولون أو الغدة الكظرية أو الكلى.
سيستخدم أخصائي علم الأمراض الخاص بك عمق الغزو لتحديد مرحلة الورم المرضي (pT) على النحو التالي:
- T1a: تم العثور على الخلايا السرطانية فقط في الغشاء المخاطي. ويسمى هذا أيضًا بالسرطان الغدي داخل المخاطية.
- T1b: انتشرت الخلايا السرطانية إلى الطبقة تحت المخاطية.
- T2: انتشرت الخلايا السرطانية في العضلات المخصوصة.
- T3: توجد الخلايا السرطانية في الأنسجة الرخوة تحت المصلية أسفل السطح الخارجي للمعدة مباشرة.
- T4a: لقد مرت الخلايا السرطانية عبر المصل وتوجد على السطح الخارجي للمعدة.
- T4b: انتشرت الخلايا السرطانية إلى الأعضاء القريبة من المعدة
HER2
تنتج الخلايا في جميع أنحاء الجسم HER2 البروتين، الذي يعمل كمفتاح لتعزيز نمو الخلايا وانقسامها. ومع ذلك، عندما تقوم الخلايا السرطانية بإفراط في إنتاج HER2، فإنها تنمو وتنقسم بشكل أسرع بكثير من الخلايا الطبيعية. ما يقرب من واحد من كل خمسة أورام في المعدة يفرط في إنتاج HER2. لذلك، سيقوم أخصائي علم الأمراض الخاص بك باختبار الخلايا السرطانية لديك بحثًا عن وجود HER2.
الكيمياء الهيستولوجية المناعية (IHC) هو الاختبار الأكثر استخدامًا للكشف عن HER2 في الخلايا السرطانية. طريقة أخرى تسمى التألق في الموقع التهجين (FISH). لن تقوم بعض المختبرات بإجراء اختبار FISH إلا بعد أن ينتج اختبار IHC نتيجة ملتبسة.
إذا تم اختبار الورم باستخدام الكيمياء المناعية، فسيقوم تقريرك بتصنيف النتائج على النحو التالي:
- سلبي (0 أو 1) - يشير إلى أن الخلايا السرطانية لا تفرط في إنتاج HER2.
- ملتبس (2) - يشير إلى أن الخلايا السرطانية قد تفرط في إنتاج HER2.
– إيجابي (3) – يؤكد أن الخلايا السرطانية تفرط في إنتاج HER2.
قد يكون المرضى الذين يعانون من أورام HER2 إيجابية مؤهلين لعلاجات محددة. ناقش مع طبيبك خيارات العلاج المتاحة لك.
بروتينات إصلاح عدم التطابق (MMR)
يعد إصلاح عدم التطابق (MMR) نظامًا مهمًا داخل جميع الخلايا الطبيعية والصحية التي تصحح أخطاء الحمض النووي. يعتمد هذا النظام على بروتينات مختلفة، بشكل رئيسي MSH2، MSH6، MLH1، وPMS2.
تقترن هذه البروتينات الأربعة، MSH2 وMSH6 وMLH1 وPMS2 (MSH2 مع MSH6 وMLH1 مع PMS2) لإصلاح الحمض النووي التالف. إذا كان البروتين مفقودًا، فلن يتمكن زوجه من إصلاح الحمض النووي بشكل فعال، مما يزيد من خطر الإصابة بالسرطان.
يجري علماء الأمراض اختبارات إصلاح عدم التطابق على عينات الورم للتحقق من عدم وجود أي من هذه البروتينات، وهي عملية مفصلة في تقارير علم الأمراض. الطريقة الأساسية لهذا الاختبار هي الكيمياء المناعية، والذي يحدد ما إذا كانت الخلايا السرطانية تنتج بروتينات الإصلاح الأربعة غير المتطابقة.
في حالة غياب البروتين، سيشير تقرير علم الأمراض إلى أنه "مفقود" أو "ناقص". في كثير من الأحيان، عند فقدان بروتين واحد، يتم فقدان زوج منه أيضًا. إذا تم التعبير عن البروتين بشكل طبيعي، فسوف يشير تقرير علم الأمراض إلى أنه "سليم".
بالنسبة لسرطان المعدة الغدي، يشير غياب واحد أو أكثر من بروتينات الإصلاح غير المتطابقة عادةً إلى تشخيص أفضل ويشير إلى استجابة أعلى محتملة لمثبطات نقطة التفتيش المناعية، وهو نوع من علاج السرطان.
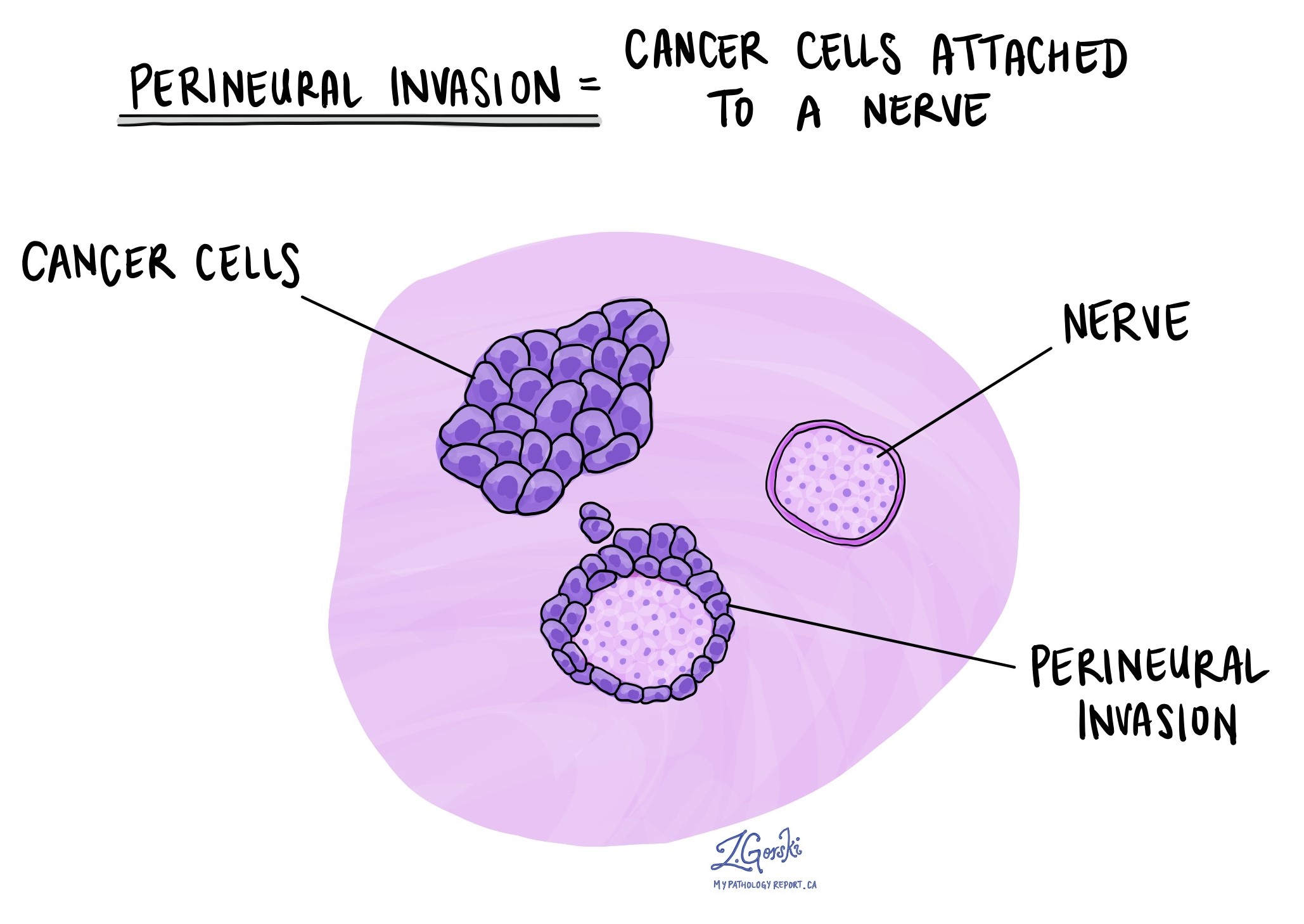
الغزو المحيطي
يستخدم علماء الأمراض مصطلح "الغزو حول العصب" لوصف الحالة التي تلتصق فيها الخلايا السرطانية بالعصب أو تغزوه. "الغزو داخل العصب" هو مصطلح ذو صلة يشير على وجه التحديد إلى الخلايا السرطانية الموجودة داخل العصب. تتكون الأعصاب، التي تشبه الأسلاك الطويلة، من مجموعات من الخلايا تعرف باسم الخلايا العصبية. تنقل هذه الأعصاب الموجودة في جميع أنحاء الجسم معلومات مثل درجة الحرارة والضغط والألم بين الجسم والدماغ. يعد وجود الغزو حول العصب أمرًا مهمًا لأنه يسمح للخلايا السرطانية بالانتقال على طول العصب إلى الأعضاء والأنسجة القريبة، مما يزيد من خطر تكرار الورم بعد الجراحة.
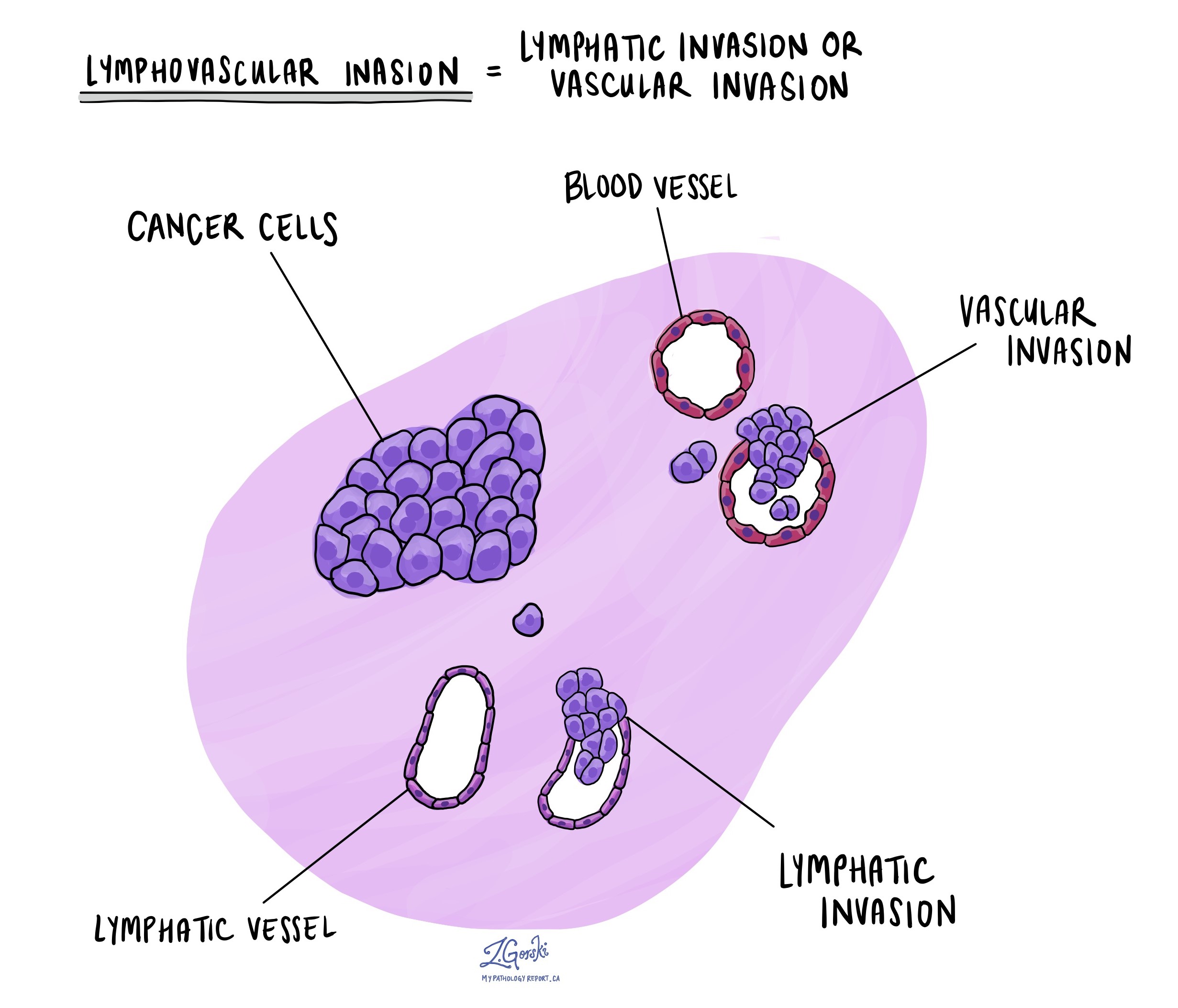
غزو الأوعية الدموية اللمفاوية
يحدث غزو الأوعية اللمفاوية عندما تغزو الخلايا السرطانية وعاءً دمويًا أو وعاءً ليمفاويًا. الأوعية الدموية، وهي أنابيب رفيعة تحمل الدم في جميع أنحاء الجسم، تتناقض مع الأوعية اللمفاوية، التي تحمل سائلًا يسمى اللمف بدلاً من الدم. تتصل هذه الأوعية اللمفاوية بأعضاء مناعية صغيرة تعرف باسم الغدد الليمفاوية، منتشرة في جميع أنحاء الجسم. يعد غزو الأوعية اللمفاوية مهمًا لأنه يمكّن الخلايا السرطانية من الانتشار إلى أجزاء أخرى من الجسم، بما في ذلك العقد الليمفاوية أو الكبد، عبر الدم أو الأوعية اللمفاوية.
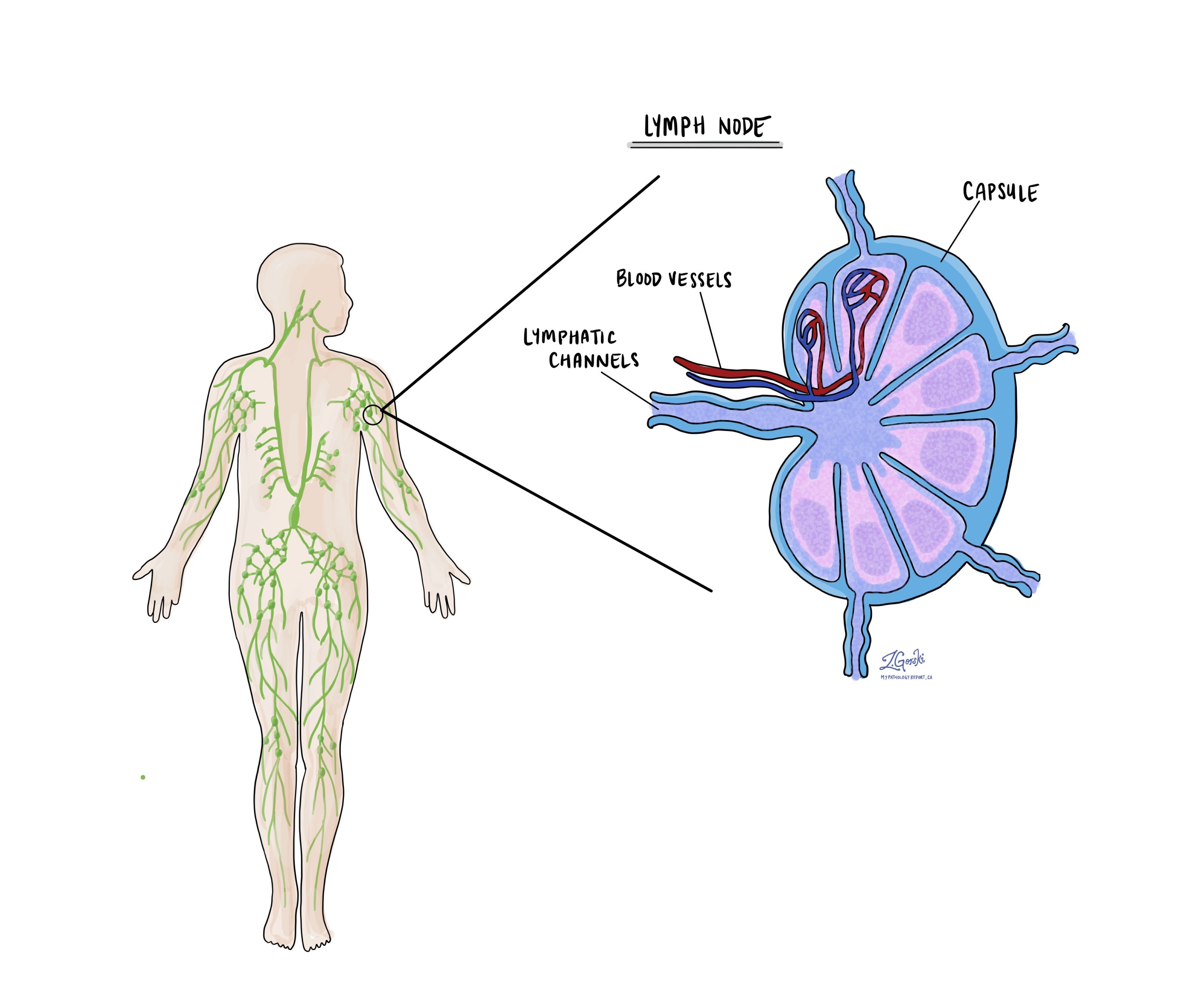
الغدد الليمفاوية
توجد أعضاء مناعية صغيرة، تُعرف باسم العقد الليمفاوية، في جميع أنحاء الجسم. يمكن للخلايا السرطانية أن تنتقل من الورم إلى هذه العقد الليمفاوية عبر الأوعية اللمفاوية الصغيرة. لهذا السبب، يقوم الأطباء في كثير من الأحيان بإزالة العقد الليمفاوية وفحصها مجهريا للبحث عن الخلايا السرطانية. وتسمى هذه العملية، حيث تنتقل الخلايا السرطانية من الورم الأصلي إلى جزء آخر من الجسم مثل العقدة الليمفاوية ورم خبيث.
عادةً ما تهاجر الخلايا السرطانية أولاً إلى العقد الليمفاوية القريبة من الورم، على الرغم من أن العقد الليمفاوية البعيدة قد تتأثر أيضًا. وبالتالي، عادةً ما يقوم الجراحون بإزالة العقد الليمفاوية الأقرب إلى الورم أولاً. وقد يقومون بإزالة العقد الليمفاوية البعيدة عن الورم إذا كانت متضخمة وكان هناك شك قوي في أنها تحتوي على خلايا سرطانية.
سيقوم أخصائيو علم الأمراض بفحص أي عقد ليمفاوية تمت إزالتها تحت المجهر، وسيتم تفصيل النتائج في تقريرك. وتشير النتيجة "الإيجابية" إلى وجود خلايا سرطانية في العقدة الليمفاوية، بينما تعني النتيجة "السلبية" عدم وجود خلايا سرطانية. إذا وجد التقرير خلايا سرطانية في عقدة ليمفاوية، فقد يحدد أيضًا حجم أكبر مجموعة من هذه الخلايا، والتي يشار إليها غالبًا باسم "البؤرة" أو "الوديعة". التمديد الخارجي يحدث عندما تخترق الخلايا السرطانية الكبسولة الخارجية للعقدة الليمفاوية وتنتشر في الأنسجة المجاورة.
فحص العقد الليمفاوية مهم لسببين. أولاً، يساعد في تحديد المرحلة العقدية المرضية (pN). ثانيًا، يشير اكتشاف الخلايا السرطانية في العقدة الليمفاوية إلى زيادة خطر العثور على خلايا سرطانية في أجزاء أخرى من الجسم لاحقًا. ترشد هذه المعلومات طبيبك في تحديد ما إذا كنت بحاجة إلى علاجات إضافية، مثل العلاج الكيميائي أو العلاج الإشعاعي أو العلاج المناعي.
هوامش
في علم الأمراض، الهامش هو حافة الأنسجة التي تمت إزالتها أثناء جراحة الورم. تعتبر حالة الهامش في تقرير علم الأمراض مهمة لأنها تشير إلى ما إذا كان الورم بأكمله قد تمت إزالته أو ما إذا كان قد تم ترك بعض منه. تساعد هذه المعلومات في تحديد الحاجة لمزيد من العلاج.
عادةً ما يقوم علماء الأمراض بتقييم الهوامش بعد إجراء عملية جراحية مثل استئصال or استئصال، بهدف إزالة الورم بأكمله. لا يتم تقييم الهوامش عادة بعد أ خزعة، والذي يزيل جزءًا فقط من الورم. يختلف عدد الهوامش المبلغ عنها وحجمها - مقدار الأنسجة الطبيعية الموجودة بين الورم والحافة المقطوعة - بناءً على نوع النسيج وموقع الورم.
يقوم علماء الأمراض بفحص الهوامش للتحقق من وجود خلايا سرطانية عند الحافة المقطوعة للأنسجة. يشير الهامش الإيجابي، حيث توجد الخلايا السرطانية، إلى احتمال بقاء بعض أنواع السرطان في الجسم. في المقابل، يشير الهامش السلبي، مع عدم وجود خلايا ورم عند الحافة، إلى أن الورم قد تمت إزالته بالكامل. تقوم بعض التقارير أيضًا بقياس المسافة بين أقرب الخلايا السرطانية والهامش، حتى لو كانت جميع الهوامش سلبية.

حول هذا المقال
كتب الأطباء هذه المقالة لمساعدتك على قراءة وفهم تقرير الحالة المرضية الخاص بك. تواصل معنا إذا كانت لديك أسئلة حول هذه المقالة أو تقرير علم الأمراض الخاص بك. للحصول على مقدمة كاملة لتقرير علم الأمراض الخاص بك، اقرأ هذا المقال.


